Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
вода
Синонимы и иностранные названия:
dihydrogen monoxide (англ.)
hydrogen oxide (англ.)
water (англ.)
водорода гидроокись (рус.)
водорода оксид (рус.)
диводорода окись (рус.)
оксинан (рус.)
Тип вещества:
неорганическое
Внешний вид:
бесцветн. жидкостьКристаллические модификации, структура молекулы, цвет растворов и паров:
В твердом виде образует несколько модификаций: Ih (гексагональная структура, обычный лёд) существует при 0 C, плотность 0,917 г/см3; Ic (кубическая модификация), существует при -133 C, плотность 0,93 г/см3; II (при -33 C и 210 МПа), плотность 1,18 г/см3; III (при -22 C и 200 МПа), плотность 1,15 г/см3; V (при -5 С и 800 МПа), плотность 1,26 г/см3; VI (при +35 С и 800 МПа), плотность 1,34 г/см3; VII (при 25 С и 2500 МПа), плотность 1,65 г/см3. Резким охлаждением водяного пара ниже -124 С может быть получен аморфный лед с плотностью 2,3 г/см3.
В жидком виде ассоциирована.
Брутто-формула (по системе Хилла для органических веществ):
H2OФормула в виде текста:
H2OМолекулярная масса (в а.е.м.): 18,02
CAS №: 7732-18-5
Температура плавления (в °C):
0Температура кипения (в °C):
100Критическая температура (в °C):
374,15 [Лит.]
Критическое давление (в МПа):
22,06 [Лит.]
Критическая плотность (в г/см3):
0,322 [Лит.]
Температуры плавления под давлением (в °C):
-5 (61,808 МПа)
-20 (199,61 МПа)
-22 (214,3 МПа)
-20 (254,3 МПа)
-17 (357,677 МПа)
0 (644,427 МПа)
73,8 (2026,5 МПа)
81,6 (2269,7 МПа)
153 (3120 МПа, лёд VII)
192 (3900 МПа)
217 (4280 МПа, лёд VII)
301 (7030 МПа, лёд VII)
371,5 (12500 МПа, лёд VII)
386,5 (13980 МПа, лёд VII)
403 (16020 МПа, лёд VII)
442,5 (19910 МПа, лёд VII)
767 (35000 МПа, тройная точка жидкость - лёд VII - лёд X)
Температурные константы смесей (содержание в весовых процентах):
-137 °C (температура плавления эвтектической смеси) вода 6,7% метанол 93,3%
-100,3 °C (температура плавления эвтектической смеси) аммиак 33,23% вода 66,77%
-74,7 °C (температура плавления эвтектической смеси) вода 77% хлороводород 23%
-56,1 °C (температура плавления эвтектической смеси) вода 38,8% водорода пероксид 61,2%
-55 °C (температура плавления эвтектической смеси) вода 70,1% кальция хлорид 29,9%
-48 °C (температура плавления эвтектической смеси) вода 6,1% лития перхлорат 36,2% метилсульфонилметан 57,7%
-26,7 °C (температура плавления эвтектической смеси) вода 40% уксусная кислота 60%
-21,2 °C (температура плавления эвтектической смеси) вода 76,9% натрия хлорид 23,1%
-19,5 °C (температура плавления эвтектической смеси) вода 71,2% метаналь 28,8%
-18,5 °C (температура плавления эвтектической смеси) вода 63,1% натрия нитрат 36,9%
-16,9 °C (температура плавления эвтектической смеси) аммония нитрат 42,4% вода 57,6%
-15,3 °C (температура плавления эвтектической смеси) аммония динитрамид 58% вода 42%
-11,5 °C (температура плавления эвтектической смеси) вода 67,5% мочевина 32,5%
38,1 °C (температура кипения азеотропа, давление 1 атм) вода 1,5% дихлорметан 98,5%
43,6 °C (температура кипения азеотропа, давление 1 атм) вода 2% углерода дисульфид 98%
52,4 °C (температура кипения азеотропа, давление 1 атм) вода 2,6% пропеналь 97,4%
56,2 °C (температура кипения азеотропа, давление 1 атм) вода 2,6% трихлорметан 97,4%
56,4 °C (температура кипения азеотропа, давление 1 атм) вода 3% гексан 79% этанол 18%
61,6 °C (температура кипения азеотропа, давление 1 атм) вода 5,6% гексан 94,4%
62,14 °C (температура кипения азеотропа, давление 1 атм) бензол 20,4% вода 6,1% циклогексан 54,3% этанол 19,2%
64,79 °C (температура кипения азеотропа, давление 1 атм) бензол 62,4% вода 6,8% гептан 12,1% этанол 18,7%
66 °C (температура кипения азеотропа, давление 1 атм) вода 4,1% тетрахлорметан 95,9%
68,1 °C (температура кипения азеотропа, давление 1 атм) 1-хлорбутан 93,4% вода 6,6%
69,8 °C (температура кипения азеотропа, давление 1 атм) бензол 91% вода 9%
70,4 °C (температура кипения азеотропа, давление 1 атм, гетерогенный) вода 8,2% уксусной кислоты этиловый эфир 91,8%
74,35 °C (температура кипения азеотропа, давление 1 атм) вода 22% этилнитрат 78%
74,4 °C (температура кипения азеотропа, давление 1 атм) вода 12% метилбензол 51% этанол 37%
75,2 °C (температура кипения азеотропа, давление 1 атм) вода 10% диэтоксиметан 90%
76,15 °C (температура кипения азеотропа, давление 1 атм, гетерогенный) 1,1,2,2-тетрахлорэтан 7,8% вода 32,3% нитрометан 37,5% октан 11,6% пропан-1-ол 10,8%
76,3 °C (температура кипения азеотропа, давление 1 атм) вода 13,1% метилбензол 48,7% пропан-2-ол 38,2%
78,174 °C (температура кипения азеотропа, давление 1 атм) вода 4% этанол 96%
79,9 °C (температура кипения азеотропа, давление 1 атм) 2-метилпропан-2-ол 88,2% вода 11,8%
80,3 °C (температура кипения азеотропа, давление 1 атм) вода 12,4% пропан-2-ол 87,6%
83,59 °C (температура кипения азеотропа, давление 1 атм) вода 23,6% нитрометан 76,4%
87 °C (температура кипения азеотропа, давление 1 атм) 2-метилпропан-1-ол 73,2% вода 26,8%
87,22 °C (температура кипения азеотропа, давление 1 атм) вода 28,5% нитроэтан 71,5%
87,65 °C (температура кипения азеотропа, давление 1 атм) вода 28,3% пропан-1-ол 71,7%
88,55 °C (температура кипения азеотропа, давление 1 атм) 2-нитропропан 70,6% вода 29,4%
88,89 °C (температура кипения азеотропа, давление 1 атм) вода 27,7% проп-2-ен-1-ол 72,3%
90,1 °C (температура кипения азеотропа, давление 1 атм, гетерогенный) вода 71,5% уксусной кислоты бутиловый эфир 28,5%
90,2 °C (температура кипения азеотропа, давление 1 атм) вода 28,4% хлорбензол 71,6%
91,32 °C (температура кипения азеотропа, давление 1 атм) 1,3,5-триоксан 69,9% вода 30,1%
91,63 °C (температура кипения азеотропа, давление 1 атм) 1-нитропропан 63,5% вода 36,5%
94,2 °C (температура кипения азеотропа, давление 1 атм) вода 41% пропеновой кислоты бутиловый эфир 59%
96 °C (температура кипения азеотропа, давление 1 атм) вода 46% трипропиламин 54%
96,3 °C (температура кипения азеотропа, давление 1 атм) вода 55% циклогексанон 45%
98 °C (температура кипения азеотропа, давление 1 атм) вода 72% гептафторбутановая кислота 28%
98,6 °C (температура кипения азеотропа, давление 1 атм) вода 73% диметилсульфат 27%
99,6 °C (температура кипения азеотропа, давление 1 атм) вода 90,8% фенол 9,2%
105 °C (температура кипения азеотропа, давление 1 атм) бромоводород 10,4% вода 11% хлорбензол 78,6%
105,46 °C (температура кипения азеотропа, давление 1 атм) вода 20,6% трифторуксусная кислота 79,4%
107,65 °C (температура кипения азеотропа, давление 1 атм) вода 25,5% муравьиная кислота 74,5%
108,584 °C (температура кипения азеотропа, давление 1 атм) вода 79,778% хлороводород 20,222%
111,35 °C (температура кипения азеотропа, давление 1 атм) вода 64,4% фтороводород 35,6%
119 °C (температура кипения азеотропа, давление 1 атм) вода 18,4% этан-1,2-диамин 81,6%
120 °C (температура кипения азеотропа, давление 1 атм) вода 32,3% гидразин 67,7%
121,9 °C (температура кипения азеотропа, давление 1 атм) азотная кислота 68,4% вода 31,6%
126 °C (температура кипения азеотропа, давление 1 атм) бромоводород 47,5% вода 52,5%
127 °C (температура кипения азеотропа, давление 1 атм) вода 43% иодоводород 57%
203 °C (температура кипения азеотропа, давление 1 атм) вода 28,4% хлорная кислота 71,6%
330 °C (температура кипения азеотропа, давление 1 атм) вода 1,7% серная кислота 98,3%
869 °C (температура кипения азеотропа, давление 1 атм) вода 8% фосфора(V) оксид 92%
Растворимость (в г/100 г растворителя или характеристика):
1,1,1,2-тетрахлорэтан: 0,023 (0°C) [Лит.]
1,1,1,2-тетрахлорэтан: 0,0555 (25°C) [Лит.]
1,1,1,2-тетрахлорэтан: 0,06 (30°C) [Лит.]
1,1,1-трихлорэтан: 0,0162 (0°C) [Лит.]
1,1,1-трихлорэтан: 0,0339 (25°C) [Лит.]
1,1,1-трихлорэтан: 0,042 (30°C) [Лит.]
1,1,2,2-тетрафтор-1,2-дихлорэтан: 0,00002 (-70°C) [Лит.]
1,1,2,2-тетрафтор-1,2-дихлорэтан: 0,00005 (-60°C) [Лит.]
1,1,2,2-тетрафтор-1,2-дихлорэтан: 0,0001 (-50°C) [Лит.]
1,1,2,2-тетрафтор-1,2-дихлорэтан: 0,0002 (-40°C) [Лит.]
1,1,2,2-тетрафтор-1,2-дихлорэтан: 0,0004 (-30°C) [Лит.]
1,1,2,2-тетрафтор-1,2-дихлорэтан: 0,0009 (-20°C) [Лит.]
1,1,2,2-тетрафтор-1,2-дихлорэтан: 0,0015 (-10°C) [Лит.]
1,1,2,2-тетрафтор-1,2-дихлорэтан: 0,0027 (0°C) [Лит.]
1,1,2,2-тетрафтор-1,2-дихлорэтан: 0,0071 (20°C) [Лит.]
1,1,2,2-тетрафтор-1,2-дихлорэтан: 0,0134 (35°C) [Лит.]
1,1,2,2-тетрахлорэтан: 0,0584 (0°C) [Лит.]
1,1,2,2-тетрахлорэтан: 0,11 (25°C) [Лит.]
1,1,2,2-тетрахлорэтан: 0,132 (30°C) [Лит.]
1,1,2-трифтор-1,2,2-трихлорэтан: 0,0008 (-30°C) [Лит.]
1,1,2-трифтор-1,2,2-трихлорэтан: 0,0018 (-20°C) [Лит.]
1,1,2-трифтор-1,2,2-трихлорэтан: 0,0022 (-10°C) [Лит.]
1,1,2-трифтор-1,2,2-трихлорэтан: 0,0036 (0°C) [Лит.]
1,1,2-трифтор-1,2,2-трихлорэтан: 0,0086 (20°C) [Лит.]
1,1,2-трифтор-1,2,2-трихлорэтан: 0,009 (21°C) [Лит.]
1,1,2-трифтор-1,2,2-трихлорэтан: 0,0154 (35°C) [Лит.]
1,1,2-трихлорэтан: 0,062 (0°C) [Лит.]
1,1,2-трихлорэтан: 0,119 (25°C) [Лит.]
1,1,2-трихлорэтан: 0,159 (30°C) [Лит.]
1,1-дихлорэтан: 0,046 (0°C) [Лит.]
1,1-дихлорэтан: 0,0966 (25°C) [Лит.]
1,1-дихлорэтан: 0,115 (30°C) [Лит.]
1,2-дибромэтан: 0,0657 (25°C) [Лит.]
1,2-дибромэтан: 0,0715 (30°C) [Лит.]
1,2-дихлорэтан: 0,09 (0°C) [Лит.]
1,2-дихлорэтан: 0,15 (20°C) [Лит.]
1,2-дихлорэтан: 0,187 (25°C) [Лит.]
1,2-дихлорэтан: 0,22 (30°C) [Лит.]
1-бутанол: 25,11 (20°C) [Лит.]
1-октанол: 5,077 (2,41°C) [Лит.]
1-октанол: 5,084 (10,4°C) [Лит.]
1-октанол: 5,118 (20°C) [Лит.]
1-октанол: 5,141 (25,13°C) [Лит.]
1-октанол: 5,285 (35,66°C) [Лит.]
1-октанол: 5,704 (56,66°C) [Лит.]
1-октанол: 6,794 (96,5°C) [Лит.]
1-пентанол: 10,4 (20°C) [Лит.]
2-бутанол: 58,7 (20°C) [Лит.]
2-бутанон: 13,8 (20°C) [Лит.]
2-гептанон: 2,2 (25°C) [Лит.]
2-пентанон: 3,7 (25°C) [Лит.]
азот жидкий: 0,00064 (-195,8°C) [Лит.]
анилин: 4,68 (16°C) [Лит.]
анилин: 5,13 (22°C) [Лит.]
бензол: 0,0451 (10°C) [Лит.]
бензол: 0,0573 (20°C) [Лит.]
бензол: 0,0746 (30°C) [Лит.]
бензол: 0,0953 (40°C) [Лит.]
бензол: 0,1271 (50°C) [Лит.]
бензол: 0,1637 (60°C) [Лит.]
бром жидкий: 0,029 [Лит.]
бутилакрилат: 0,7 [Лит.]
бутилацетат: 2,4 (20°C) [Лит.]
валериановая кислота: 10,6 (16°C) [Лит.]
гексадекафторгептан: 0,0022 (25°C) [Лит.]
гексадекафторгептан: 0,0054 (50°C) [Лит.]
гексан: 0,01 (20°C) [Лит.]
гептан: 0,015 (20°C) [Лит.]
диизопропиловый эфир: 0,87 (20°C) [Лит.]
диметоксиметан: 4,5 (16°C) [Лит.]
диоксид серы: растворим [Лит.]
дифтордихлорметан: 0,00001 (-70°C) [Лит.]
дифтордихлорметан: 0,00003 (-60°C) [Лит.]
дифтордихлорметан: 0,00008 (-50°C) [Лит.]
дифтордихлорметан: 0,0002 (-40°C) [Лит.]
дифтордихлорметан: 0,0004 (-30°C) [Лит.]
дифтордихлорметан: 0,0007 (-20°C) [Лит.]
дифтордихлорметан: 0,0014 (-10°C) [Лит.]
дифтордихлорметан: 0,0025 (0°C) [Лит.]
дифтордихлорметан: 0,0043 (10°C) [Лит.]
дифтордихлорметан: 0,0072 (20°C) [Лит.]
дифтордихлорметан: 0,0116 (30°C) [Лит.]
дифтордихлорметан: 0,0181 (40°C) [Лит.]
дифторхлорметан: 0,0024 (-70°C) [Лит.]
дифторхлорметан: 0,0042 (-60°C) [Лит.]
дифторхлорметан: 0,0073 (-50°C) [Лит.]
дифторхлорметан: 0,012 (-40°C) [Лит.]
дифторхлорметан: 0,019 (-30°C) [Лит.]
дифторхлорметан: 0,028 (-20°C) [Лит.]
дифторхлорметан: 0,042 (-10°C) [Лит.]
дифторхлорметан: 0,059 (0°C) [Лит.]
дифторхлорметан: 0,082 (10°C) [Лит.]
дифторхлорметан: 0,111 (20°C) [Лит.]
дифторхлорметан: 0,147 (30°C) [Лит.]
дифторхлорметан: 0,191 (40°C) [Лит.]
дихлорметан: 0,085 (0°C) [Лит.]
дихлорметан: 0,142 (20°C) [Лит.]
дихлорметан: 0,17 (25°C) [Лит.]
дихлорметан: 0,196 (30°C) [Лит.]
диэтиловый эфир: 1,47 (20°C) [Лит.]
изоамиловый спирт: 10,6 (20°C) [Лит.]
изобутилакрилат: 0,6 [Лит.]
изопентан: 0,0097 (20°C) [Лит.]
кислород жидкий: 0,00057 (-183°C) [Лит.]
м-ксилол: 0,03 (20°C) [Лит.]
метан жидкий: 0,0068 (-161,2°C) [Лит.]
метанол: смешивается [Лит.]
метил-трет-бутиловый эфир: 1,5 (20°C) [Лит.]
нитробензол: 0,19 (20°C) [Лит.]
нитрометан: 2 (20°C) [Лит.]
октан: 0,014 (20°C) [Лит.]
п-крезол: 16,3 (37,1°C) [Лит.]
п-крезол: 28,7 (110,8°C) [Лит.]
п-крезол: 64 (142,5°C) [Лит.]
п-крезол: смешивается (142,6°C) [Лит.]
пентан: 0,012 (20°C) [Лит.]
пентахлорэтан: 0,0162 (0°C) [Лит.]
пентахлорэтан: 0,0347 (25°C) [Лит.]
пентахлорэтан: 0,0414 (30°C) [Лит.]
сероуглерод: 0,0086 (10°C) [Лит.]
сероуглерод: 0,0142 (20°C) [Лит.]
стирол: 0,032 (6°C) [Лит.]
стирол: 0,066 (25°C) [Лит.]
стирол: 0,101 (40°C) [Лит.]
стирол: 0,123 (51°C) [Лит.]
тетрахлорметан: 0,005 (0°C) [Лит.]
тетрахлорметан: 0,00844 (20°C) [Лит.]
тетрахлорметан: 0,0116 (25°C) [Лит.]
тетрахлорметан: 0,0156 (30°C) [Лит.]
тетрахлорметан: 0,0109 (30°C) [Лит.]
тетрахлорметан: 0,0152 (40°C) [Лит.]
тетрахлорметан: 0,0237 (50°C) [Лит.]
тетрахлорэтилен: 0,00448 (10°C) [Лит.]
тетрахлорэтилен: 0,00725 (20°C) [Лит.]
тетрахлорэтилен: 0,01135 (30°C) [Лит.]
тетрахлорэтилен: 0,01729 (40°C) [Лит.]
тетрахлорэтилен: 0,02564 (50°C) [Лит.]
толуол: 0,0335 (10°C) [Лит.]
толуол: 0,045 (20°C) [Лит.]
толуол: 0,06 (30°C) [Лит.]
толуол: 0,0733 (40°C) [Лит.]
толуол: 0,0953 (50°C) [Лит.]
трифторхлорметан: 0,00012 (-40°C) [Лит.]
трифторхлорметан: 0,00026 (-30°C) [Лит.]
трифторхлорметан: 0,00052 (-20°C) [Лит.]
трифторхлорметан: 0,001 (-10°C) [Лит.]
трифторхлорметан: 0,0018 (0°C) [Лит.]
трифторхлорметан: 0,0024 (5°C) [Лит.]
трифторхлорметан: 0,0031 (10°C) [Лит.]
трифторхлорметан: 0,004 (15°C) [Лит.]
трифторхлорметан: 0,0052 (20°C) [Лит.]
трифторхлорметан: 0,0066 (25°C) [Лит.]
углекислый газ жидкий: очень мало растворим [Лит.]
фтордихлорметан: 0,0015 (-70°C) [Лит.]
фтордихлорметан: 0,003 (-60°C) [Лит.]
фтордихлорметан: 0,0052 (-50°C) [Лит.]
фтордихлорметан: 0,009 (-40°C) [Лит.]
фтордихлорметан: 0,015 (-30°C) [Лит.]
фтордихлорметан: 0,023 (-20°C) [Лит.]
фтордихлорметан: 0,036 (-10°C) [Лит.]
фтордихлорметан: 0,054 (0°C) [Лит.]
фтордихлорметан: 0,078 (10°C) [Лит.]
фтордихлорметан: 0,112 (20°C) [Лит.]
фтордихлорметан: 0,156 (30°C) [Лит.]
фтордихлорметан: 0,214 (40°C) [Лит.]
фтортрихлорметан: 0,00004 (-70°C) [Лит.]
фтортрихлорметан: 0,00009 (-60°C) [Лит.]
фтортрихлорметан: 0,0002 (-50°C) [Лит.]
фтортрихлорметан: 0,0004 (-40°C) [Лит.]
фтортрихлорметан: 0,0007 (-30°C) [Лит.]
фтортрихлорметан: 0,0013 (-20°C) [Лит.]
фтортрихлорметан: 0,0022 (-10°C) [Лит.]
фтортрихлорметан: 0,0036 (0°C) [Лит.]
фтортрихлорметан: 0,0056 (10°C) [Лит.]
фтортрихлорметан: 0,0086 (20°C) [Лит.]
фтортрихлорметан: 0,013 (30°C) [Лит.]
фтортрихлорметан: 0,018 (40°C) [Лит.]
фурфурол: 4,8 (20°C) [Лит.]
хлорметан: 0,003 (-60°C) [Лит.]
хлорметан: 0,006 (-50°C) [Лит.]
хлорметан: 0,01 (-40°C) [Лит.]
хлороводород жидкий безводный: не растворим [Лит.]
хлороформ: 0,053 (0°C) [Лит.]
хлороформ: 0,0932 (25°C) [Лит.]
хлороформ: 0,113 (30°C) [Лит.]
циклогексан: 0,005 (14°C) [Лит.]
циклогексан: 0,01 (19°C) [Лит.]
циклогексан: 0,015 (28,5°C) [Лит.]
циклогексан: 0,02 (32,5°C) [Лит.]
циклогексан: 0,031 (38°C) [Лит.]
циклогексан: 0,05 (53°C) [Лит.]
циклогексанол: 11,27 (11°C) [Лит.]
этанол: смешивается [Лит.]
этилацетат: 3,3 (20°C) [Лит.]
этилбензол: 0,33 (20°C) [Лит.]
Плотность:
0,999841 (0°C, г/см3, состояние вещества - жидкость)
0,9999 (1°C, г/см3, состояние вещества - жидкость)
0,999941 (2°C, г/см3, состояние вещества - жидкость)
0,999965 (3°C, г/см3, состояние вещества - жидкость)
0,99997 (4°C, г/см3, состояние вещества - жидкость)
0,999965 (5°C, г/см3, состояние вещества - жидкость)
0,9997 (10°C, г/см3, состояние вещества - жидкость)
0,9982 (20°C, г/см3, состояние вещества - жидкость)
0,9971 (25°C, г/см3, состояние вещества - жидкость)
0,99565 (30°C, г/см3, состояние вещества - жидкость)
0,99403 (35°C, г/см3, состояние вещества - жидкость)
0,99221 (40°C, г/см3, состояние вещества - жидкость)
0,99022 (45°C, г/см3, состояние вещества - жидкость)
0,98804 (50°C, г/см3, состояние вещества - жидкость)
0,9857 (55°C, г/см3, состояние вещества - жидкость)
0,98321 (60°C, г/см3, состояние вещества - жидкость)
0,98056 (65°C, г/см3, состояние вещества - жидкость)
0,97777 (70°C, г/см3, состояние вещества - жидкость)
0,97486 (75°C, г/см3, состояние вещества - жидкость)
0,9718 (80°C, г/см3, состояние вещества - жидкость)
0,96862 (85°C, г/см3, состояние вещества - жидкость)
0,96531 (90°C, г/см3, состояние вещества - жидкость)
0,96189 (95°C, г/см3, состояние вещества - жидкость)
0,95836 (100°C, г/см3, состояние вещества - жидкость)
Вкус, запах, гигроскопичность:
вкус: без вкуса
запах: без запаха
Энергии, длины и углы связей молекул вещества:
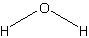
Длина связи (пм): 95,7 (H-O)
Угол связи (°): 104,5 (H-O-H)
Некоторые числовые свойства вещества:
Криоскопическая константа (К·кг/моль): 1,86
Магнитная восприимчивость (мм3/кг): -0,7199 (при 20 С)
Поляризуемость молекул (нм3): 0,00145 (электронная)
Потенциал ионизации (эВ): 12,6 (первый)
Сродство к протону (эВ): 7,1
Электрическое сопротивление (мкОм·м): 0,4 (лёд при 0 С)
Электрическое сопротивление (мкОм·м): 1,47 (жидкая вода при 0 С)
Электрическое сопротивление (мкОм·м): 18,9 (жидкая вода при 50 С)
Нормативные документы, связанные с веществом:
- ГОСТ Р № 52501-2005 от 01.01.2007 "Вода для лабораторного анализа. Технические условия" (Описание документа: Требования к воде 1 и 2 степени чистоты, в том числе и к бидистиллированной воде. Методы ее анализа.)
- ГОСТ Р № 58144-2018 "Вода дистиллированная. Технические условия" (Описание документа: Требования к дистиллированной воде. Методы ее анализа.)
Способы получения:
- При нагревании выше 400°С водород реагирует с кислородом (около 600°С - с воздухом) с образованием воды. В присутствии катализаторов (платины, соединений родия) реакция может идти при комнатной температуре. Если водород и кислород уже смешаны - реакция идет со взрывом. [Лит.1]
2H2 + O2 → 2H2O
Используется для синтеза веществ:
дифенилметанон
Реакции вещества:
- При пропускании паров воды через раскаленный уголь образуется смесь из водорода и угарного газа, называемая водяной газ. [Лит.]
C + H2O → CO + H2
- Реагирует с атомарным кислородом с образованием перекиси водорода. [Лит.]
- С галогенами, кроме фтора, обратимо реагирует с образованием смеси галогеноводорода и HHalO. [Лит.]
- Взаимодействует со многими металлами (например, с щелочными и щелочноземельными металлами реакция идет при комнатной температуре) с выделением водорода. [Лит.]
- При 2000 С разлагается на водород и кислород на 8%, при 2500 С - на 11%. Водород и кислород могут быть разделены диффузией через пористые трубки. [Лит.]
- Нагретая вода горит во фторе бледно-фиолетовым пламенем с образованием озонированного кислорода и фтороводорода. [Лит.1, Лит.2]
2H2O + 2F2 → 4HF + O2
- Смесь льда с жидким фтором чувствительна к удару с мощностью взрыва сравнимой с тротилом. [Лит.1]
- Калий энергично реагирует с водой, даже при низких температурах (-100 С), с образованием гидроксида калия и водорода. Калий при комнатной температуре воспламеняется и взрывается с водой. Калий сгорает ярким пламенем на льду. [Лит.1]
2K + 2H2O → 2KOH + H2
- Натрий энергично реагирует с водой при комнатной температуре с выделением водорода и образованием гидроксида натрия. При реакции с водой происходит расплавление натрия, при соприкосновении значительных количеств натрия и воды происходит взрыв. Реакция с водой начинается при температуре -98 °С. [Лит.1]
2Na + 2H2O → 2NaOH + H2
- При 800 С цинк реагирует с водяным паром с образованием оксида цинка и водорода. [Лит.1]
Zn + H2O → ZnO + H2
- Водород получают пропусканием водяного пара над раскаленным докрасна (900-1000 С) железом. [Лит.1, Лит.2]
Fe + H2O → FeO + H2
- Магний реагирует с горячей водой и водяным паром с выделением водорода и образованием гидроксида магния. [Лит.1]
Mg + 2H2O → Mg(OH)2 + H2
- Гидроксид цезия получают реакцией амальгамы цезия с водой. [Лит.1]
2Cs/Hg + 2H2O → 2CsOH + H2 + 2Hg
- Оксид-тетрахлорид вольфрама(VI) гидролизуется водой с образованием вольфрамовой кислоты и хлороводорода. [Лит.1]
WOCl4 + 3H2O → H2WO4 + 4HCl
- Присоединение воды к этилену в присутствии фосфорной кислоты на силикагеле при температуре 300 С и давлении 70 атм - важный промышленный способ получения этанола. Выход 95%. [Лит.1]
C2H4 + H2O → C2H5OH
- Железо корродирует в насыщенной воздухом воде с начальной скоростью до 10 г/(м2*сут). Эта скорость через несколько дней снижается из-за образования пленки оксида железа до 1-2,5 г/(м2*сут). [Лит.1]
4Fe + 6H2O + 3O2 → 4Fe(OH)3
- Трихлорид бора гидролизуется водой до борной кислоты и хлороводорода с большим выделением тепла. [Лит.1]
2BCl3 + 6H2O → 2H3BO3 + 6HCl
- Оксид натрия реагирует с водой с образованием гидроксида натрия. [Лит.1]
Na2O + H2O → 2NaOH
- Хлорид висмута(III) легко гидролизуется водой с образованием оксихлорида висмута и соляной кислоты. [Лит.1]
BiCl3 + H2O → BiOCl + 2HCl
- Пропусканием водяного пара над коксом при 1000 С получают смесь угарного газа и водорода - так называемый водяной газ. [Лит.1]
C + H2O → CO + H2
- Водород получают электролизом водного раствора гидроксида калия. На катоде выделяется водород, на аноде - кислород. Гидроксид калия используется для увеличения электропроводности раствора. [Лит.1]
2H2O → 2H2 + O2
- Оксид азота(V) активно реагирует с водой с образованием азотной кислоты. [Лит.1]
N2O5 + H2O → 2HNO3
- Карбид кальция реагирует с водой со значительным выделением тепла, с образованием ацетилена и гидроксида кальция. [Лит.1, Лит.2]
CaC2 + 2H2O → Ca(OH)2 + C2H2
- Реакция триоксида серы с водой весьма бурная и экзотермическая. Смесь триоксида серы с водой в отношении 4 к 1 полностью превращается в пар. Для безопасного превращения триоксида серы в серную кислоту рекомендуется растворять его в концентрированной серной кислоте и полученный разбавленный олеум смешивать с большим объемом воды при перемешивании. [Лит.1]
SO3 + H2O → H2SO4
- Сульфид галлия(III) разлагется даже холодной водой с образованием гидроксида галлия и сероводорода. [Лит.1]
Ga2S3 + 6H2O → 2Ga(OH)3 + 3H2S
- Фосфорную кислоту можно получить реакцией оксида фосфора(V) с водой. [Лит.1
 ]
]
P2O5 + 3H2O → 2H3PO4
- Оксид иода(V) легко растворяется в воде с образованием иодноватой кислоты. [Лит.1]
I2O5 + H2O → 2HIO3
- Фторид таллия(III) гидролизуется водой при обычной температуре до гидроксида таллия(III) и фтороводорода. [Лит.1, Лит.2]
TlF3 + 3H2O → Tl(OH)3 + 3HF
- Реакция амида натрия с водой протекает бурно и часто приводит к воспламенению и взрыву. [Лит.1]
NaNH2 + H2O → NaOH + NH3
- Дикарбид дилития реагирует с водой с выделением ацетилена. [Лит.1]
Li2C2 + 2H2O → 2LiOH + C2H2
- Хлорноватистую кислоту с максимальной концентрацией получают растворением оксида хлора(I) в воде. Реакция обратимая. [Лит.1
 , Лит.2]
, Лит.2]
Cl2O + H2O → 2HClO
- Трифторид фосфора медленно гидролизуется водой с образованием фосфористой кислоты и фтороводорода. [Лит.1]
- Гексафторид платины реагирует с водой во фтороводороде с образованием гексафторплатината(V) гидроксония, а при избытке воды - гексафторплатината(IV) гидроксония. [Лит.1]
- Тетрафторид марганца самовоспламеняется при контакте с водой. [Лит.1]
- Гексафторид осмия окисляет воду до кислорода. [Лит.1]
- Гексафторид платины разлагает воду с выделением кислорода. [Лит.1]
- Селеноводород можно получить реакцией селенида алюминия с водой. Выход 65%. [Лит.1
 , Лит.2]
, Лит.2]
Al2Se3 + 6H2O → 2Al(OH)3 + 3H2Se
Показатель преломления (для D-линии натрия):
1,3337 (0°C)
1,3337 (10°C)
1,3330 (20°C)
1,3325 (25°C)
1,3319 (50°C)
1,3273 (60°C)
Давление паров (в мм рт.ст.):
0,03 (-50°C)
0,3 (-30°C)
0,8 (-20°C)
1 (-17,4°C)
1,9 (-10°C)
2,3 (-8°C)
2,8 (-6°C)
3,3 (-4°C)
3,9 (-2°C)
4,6 (0°C)
6,5 (5°C)
9,2 (10°C)
10 (11,2°C)
12,8 (15°C)
17,5 (20°C)
23,8 (25°C)
31,8 (30°C)
55,3 (40°C)
92,5 (50°C)
100 (51,6°C)
289,1 (75°C)
730 (98,9°C)
740 (99,3°C)
750 (99,6°C)
770 (100,4°C)
780 (100,7°C)
1520 (120°C)
3800 (151°C)
7600 (179°C)
38000 (263°C)
76000 (310°C)
Стандартный электродный потенциал:
O1 + 2H+ + 2e- → H2O, E = 2,421 (вода, 25°C)
Показатели диссоциации:
pKBH+ (1) = 0 (25°C, вода)
pKa (1) = 15,7 (20°C, вода)
pKa (1) = 31,2 (25°C, диметилсульфоксид)
pKa (2) = 29 (25°C, вода)
Диэлектрическая проницаемость:
78,3 (25°C)
Дипольный момент молекулы (в дебаях):
1,84 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
1,792 (0°C)
1,308 (10°C)
1,005 (20°C)
0,894 (25°C)
0,801 (30°C)
0,656 (40°C)
0,549 (50°C)
0,469 (60°C)
0,406 (70°C)
0,3565 (80°C)
0,3165 (90°C)
0,284 (100°C)
0,26 (107°C)
0,22 (127°C)
0,18 (147°C)
0,16 (167°C)
0,14 (187°C)
0,13 (207°C)
0,12 (227°C)
0,11 (247°C)
0,1 (267°C)
0,094 (287°C)
0,086 (307°C)
0,079 (327°C)
0,071 (347°C)
0,042 (374°C)
Поверхностное натяжение (в мН/м):
75,62 (0°C)
74,2 (10°C)
72,75 (20°C)
71,15 (30°C)
69,55 (40°C)
67,9 (50°C)
66,17 (60°C)
64,41 (70°C)
62,6 (80°C)
60,74 (90°C)
58,84 (100°C)
56,97 (110°C)
54,96 (120°C)
52,9 (130°C)
52,79 (140°C)
48,68 (150°C)
46,51 (160°C)
44,38 (170°C)
42,19 (180°C)
40 (190°C)
37,77 (200°C)
35,51 (210°C)
33,21 (220°C)
30,88 (230°C)
28,52 (240°C)
26,13 (250°C)
23,73 (260°C)
21,33 (270°C)
18,94 (280°C)
16,6 (290°C)
14,29 (300°C)
12,04 (310°C)
9,84 (320°C)
7,69 (330°C)
5,61 (340°C)
3,64 (350°C)
2,71 (355°C)
1,85 (360°C)
1,68 (361°C)
1,53 (362°C)
1,07 (365°C)
0,42 (370°C)
0,31 (371°C)
0,2 (372°C)
0,1 (373°C)
0 (374,15°C)
Скорость звука в веществе (в м/с):
1482,7 (20°C, состояние среды - жидкость)
494 (134°C, состояние среды - газ)
Удельная теплоемкость при постоянном давлении (в Дж/г·K):
4,191 (25°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль)
-285,8 (ж) [Лит.]
-241,8 (г) [Лит.]
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль)
-237,1 (ж) [Лит.]
-228,6 (г) [Лит.]
Стандартная энтропия S (298 К, Дж/(моль·K))
70 (ж) [Лит.]
188,8 (г) [Лит.]
Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K))
75,3 (ж) [Лит.]
33,6 (г) [Лит.]
Энтальпия плавления ΔHпл (кДж/моль)
6,01 (т) [Лит.]
Энтальпия кипения ΔHкип (кДж/моль)
40,65 (ж) [Лит.]
Энтальпия испарения ΔHисп (кДж/моль)
43,98 (ж) [при 25 С] [Лит.]
Природные и антропогенные источники:
Одно из самых распространенных на Земле веществ. Количество воды на поверхности Земли оценивается в 1 390 000 000 000 000 000 т, большая часть из которых находится в морях и океанах. Количество доступной для использования пресной воды в реках, озерах, болотах и водохранилищах составляет 200 000 000 000 000 т. Масса ледников Арктики, Антарктиды и высокогорных районов оценивается в 24 000 000 000 000 000 т., примерно столько же имеется подземных вод, причем только небольшая часть из них - пресные. Вода входит в состав многих минералов и горных пород, присутствует в почве, является компонентом всех живых организмов (примерно 70% веса тела взрослого человека составляет вода).
Применение:
Во всех областях человеческой деятельности.
Дополнительная информация::
Коэффициент диффузии паров в воздухе = 0,216*(T/273)1,8 см2/с (T=273-1493 К). Сильно поглощает инфракрасные лучи, но довольно прозрачна для ультрафиолетового излучения.
Имеет много аномальных свойств: аномальный максимум плотности при 4 С и то, что лед легче воды позволяет водаемам не промерзать до дна; аномально высокая теплоемкость воды имеет большое значение для климата планеты.
Неверная или противоречивая информация:
- Информация о существовании "поливоды" оказалась неверной. [Лит.]
Дополнительная информация:
В толстом слое вода имеет голубую окраску за счет поглощения красного света с длиной волны 698 нм.
Тяжелокислородная вода с изотопом кислорода 18O при 25 С имеет плотность на 11,3% больше, чем природная. Ее температура кипения 100,09 С, показатель преломления 1,33258.
Средний изотопный состав пресной воды (мол%): 1H216O = 99,73, 1H218O = 0,2, 1H217O = 0,04, 1H2H16O = 0,03.
Источники информации:
- Armarego W. L. F. Purification of Laboratory Chemicals. - 5ed. - 2003. - С. 497
- Dean J.A. Lange's handbook of chemistry. - 1999. - С. 5.87
- Holleman A.F., Wiberg E., Wiberg N. Lehrbuch der Anorganischen Chemie. - Berlin: Walter de Gruyter, 1995. - С. 238
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 583-588
- Абрамзон А.А. Поверхностно-активные вещества: Свойства и применение. - Л.: Химия, 1981. - С. 79
- Гордон А., Форд Р. Спутник химика. - М.: Мир, 1976. - С. 462
- Девяткин В.В., Ляхова Ю.М. Химия для любознательных, или о чем не узнаешь на уроке. - Ярославль: Академия Холдинг, 2000. - С. 46
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 131-147
- Неорганическая химия. - Под ред. Третьякова Ю.Д., Т.2. - М.: Academa, 2004. - С. 16-23
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 59
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 529
- Справочник химика. - Т. 3. - М.-Л.: Химия, 1965. - С. 907
- Успехи химии. - 2006. - Т.75, №1. - С. 64-85 (льды)
- Физические величины. - Под ред. Григорьева И.С., Мейлихова Е.З. - М.: Энергоатомиздат, 1991. - С. 138, 332, 370
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 394-397
- Химическая энциклопедия. - Т. 2. - М.: Советская энциклопедия, 1990. - С. 393 (рКа)
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер