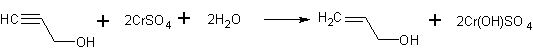
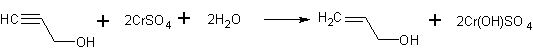
В трехгорлую колбу вместимостью 500 мл, снабженную мешалкой, трубкой для ввода азота и тонкой резиновой пробкой, в токе азота последовательно вводят водный сульфат хрома (II) (284 ммоль) и пропаргиловый спирт (130 ммоль); при этом синее окрашивание сразу же переходит в зеленое. Реакционную смесь перемешивают 1 ч, затем темно-зеленый раствор насыщают сульфатом аммония и экстрагируют эфиром. Органический слой отделяют, сушат и перегоняют.
Выход аллилового спирта 4 г (89%).
К суспензии 90,1 г параформа (1 моль) в 150 мл тетрагидрофурана добавлен раствор хлористого винилмагния (1 моль в 442 мл тетрагидрофурана), и смесь перемешана в течение 2 часов. Затем добавлено 28 мл концентрированной серной кислоты, предварительно смешанной со 100 мл воды, осадок отфильтрован и промыт 250 мл тетрагидрофурана. После отгонки растворителя остаток перегнан.
Получено 10 мл фракции с т.кип. 97-99 С, n (D, 20 C) = 1,4125. Выход 30,3%.
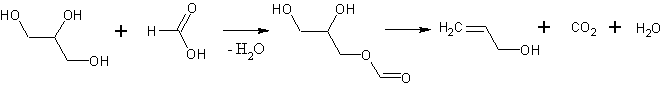
В 5-литровую круглодонную колбу помещают 2 кг (1587 мл, 21,7 мол.) глицерина и 700 г (585 мл, 12,9 мол.) технической 85%-ной муравьиной кислоты. Колбу соединяют с нисходящим холодильником и снабжают термометром, шарик которого должен быть погружен в реакционную массу. В качестве приемника удобно взять колбу Вюрца, которую герметически присоединяют к нижнему концу холодильника. Отводную трубку приемника соединяют с промывной склянкой, наполненной крепким раствором едкого натра для поглощения выделяющегося акролеина. В перегонную колбу бросают несколько кусочков глиняной тарелки для равномерного кипения и затем быстро нагревают смесь на большой кольцевой горелке (для получения хорошего выхода обязательно быстрое нагревание). Отгонка должна начаться не позже, чем через 15 мин., а через 30—45 мин смесь должна быть нагрета до 195°С. При медленном нагревании происходит осмоление и образуется большое количество акролеина, благодаря чему заметно понижается выход аллилового спирта. Дистиллят начинают собирать с того момента, когда температура реакционной смеси достигает 195°С (до этого момента отгоняется муравьиная кислота). Нагревание и отгонку продолжают до тех пор, пока температура не достигнет 260°С, причем главная масса дистиллята переходит при 225—235°С. При 260°С в колбе появляется белый пар, вследствие начинающегося разложения, и тогда нагревание прекращают. Объем дистиллята, собранного между 195 и 260°С, составляет около 750 мл. Для всей операции требуется приблизительно 4 часа.
Затем содержимому колбы дают охладиться до 100—125°С и прибавляют еще 500 г (9,2 мол.) технической 85%-ной муравьиной кислоты. После этого нагревание и отгонку повторяют таким же образом, как было указано выше, и собирают 500 мл дестиллата, переходящего при температуре реакционной смеси между 195—260°С. Остатку в колбе дают вновь охладиться и прибавляют в третий раз 500 г (9,2 мол.) 85%-ной муравьиной кислоты. Третья отгонка дает не более 350 мл нужной фракции, что доказывает, что глицерин весь вошел в реакцию, и, следовательно, дальнейшее прибавление муравьиной кислоты бесцельно. После третьей отгонки в перегонной колбе остается незначительное количество жидкости, не больше 100-200 мл. Все три операции занимают от 1 до 1,5 рабочих дней.
Все три дистиллята, собранные при температуре реакционной смеси 195—260°С, обрабатывают поташом, чтобы высолить аллиловый спирт и нейтрализовать небольшое количество муравьиной кислоты, содержащейся в них. Отслоившийся аллиловый спирт перегоняют, собирая фракцию, кипящую до 103°С, а если перегонка ведется с хорошим дефлегматором, то до 98°С. Таким образом получают 845 г водного аллилового спирта, который по титрованию бромом содержит 68—70% чистого вещества, что соответствует 570—590 г безводного аллилового спирта (45—47% теоретич.).
Перегнанный аллиловый спирт можно практически полностью обезводить кипячением с прокаленным поташом. Поташ прибавляют постепенно до тех пор, пока свежая порция, после продолжительного кипячения с обратным холодильником, не будет оставаться в жидкости в виде порошка. При просушивании по этому способу механически теряется значительное количество аллилового спирта, удерживаемого влажным поташом. Для уменьшения потерь использованный поташ собирают и высаливают им аллиловый спирт при повторении синтеза. Полученный таким образом 98—99%-ный аллиловый спирт пригоден почти для всех целей, и нет никакой надобности сушить его известью или окисью бария, как это рекомендуют некоторые авторы. Продукт, высушенный поташом, кипит при 94—97°С.
Кларк и Тэйлор, проверявшие синтез, рекомендуют для получения абсолютно безводного аллилового спирта следующий способ: продукт, полученный высаливанием поташом, перегоняют по способу, указанному выше, и, получив спирт, содержащий около 30% воды, смешивают его с четвертой частью (по объему) четыреххлористого углерода (или хлористый этилен). Затем смесь медленно перегоняют из круглодонной колбы с дефлегматором высотой не менее 80 см. Первую низкокипящую фракцию, состоящую из четыреххлористого углерода, воды и аллилового спирта, сушат поташом и выливают обратно в колбу. Этот процесс повторяют несколько раз до тех пор, пока в первой фракции почти не будет воды. Затем смесь перегоняют полностью, собирая следующие фракции: до 80°С, 80—90°С, 90—95,5°С, 95,5—97°С; последняя представляет собой спирт, который по титрованию бромом содержит 100% чистого вещества; остальные фракции сушат отдельно и снова фракционируют; таким образом получают еще некоторое количество продукта, кипящего при 95,5—97°С.
Присоединяет галогены, галогеноводороды, хлорноватистую кислоту. При взаимодействии с органическими пероксидами около 100 С (катализаторы - соединения молибдена или вольфрама) окисляется в глицидол. Обработкой концентрированной соляной кислотой при 100 С в присутствии хлорида цинка или при 20 С в присутствии хлорида меди(II) образуется аллилхлорид. При пропускании аллилового спирта над оксидом алюминия при 200-300 С образуется диаллиловый эфир.