Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
бромоводород
Синонимы и иностранные названия:
hydrogen bromide (англ.)
бромоводородная кислота (рус.)
водород бромистый (рус.)
Тип вещества:
неорганическое
Внешний вид:
бесцветн. газБрутто-формула (по системе Хилла для органических веществ):
HBrФормула в виде текста:
HBrМолекулярная масса (в а.е.м.): 80,91
Температура плавления (в °C):
-86,9Температура кипения (в °C):
-66,8Температурные константы смесей (содержание в весовых процентах):
105 °C (температура кипения азеотропа, давление 1 атм) бромоводород 10,4% вода 11% хлорбензол 78,6%
126 °C (температура кипения азеотропа, давление 1 атм) бромоводород 47,5% вода 52,5%
Растворимость (в г/100 г растворителя или характеристика):
вода: 247,3 (-20°C) [Лит.]
вода: 239 (-15°C) [Лит.]
вода: 221,2 (0°C) [Лит.]
вода: 210,3 (10°C) [Лит.]
вода: 193 (25°C) [Лит.]
вода: 171,5 (50°C) [Лит.]
вода: 150,5 (75°C) [Лит.]
вода: 130 (100°C) [Лит.]
фтороводород: не растворим [Лит.]
этанол: растворим [Лит.]
Плотность:
0,003645 (20°C, г/см3, состояние вещества - газ)
Некоторые числовые свойства вещества:
Поляризуемость молекул (нм3): 0,0036
Метод получения 1:
Источник информации: Wang, X., & Schlosser, M. A Convenient and Economic Way to Produce Anhydrous Hydrogen Bromide / Synthesis. - 1994. - No. 5 стр. 479 [doi: 10.1055/s-1994-25506](C6H5)3P + (CH3)3CBr → (C6H5)3PHBr + (CH3)2C=CH2
(C6H5)3PHBr → (C6H5)3P + HBr
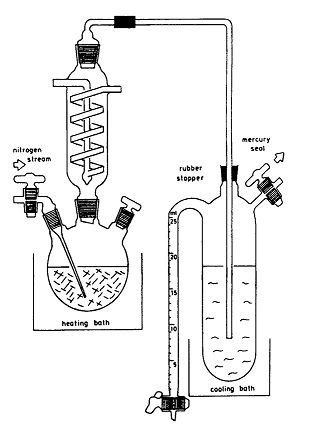
Трёхгорлую круглодонную колбу ёмкостью в 500 мл, погружённую в масляную баню и снабжённую обратным холодильником и ртутным затвором для выпуска газа, присоединяют к азотной линии. В колбу помещают 26 г (0,10 мол.) трифенилфосфина, 11 мл (14 г, 0,10 мол.) третичного бромистого бутила и 5,0 г (16 ммол.) бромистого тетрабутиламмония. Температуру бани повышают до 85°. Нагрев ведут до тех пор, пока слабое кипение раствора не прекратится, что обычно происходит через 3 часа. Затем на верх обратного холодильника укрепляют керн с изогнутой стеклянной трубочкой, конец которой погружён в сосуд Шленка, окружённый смесью льда и соли. В этот сосуд помещают 100 мл сухого эфира.
В колбу вливают 50 мл ксилола и смесь нагревают до слабого кипения, одновременно пропуская через неё медленный ток азота из капиллярной трубки. Избыток азота выходит из сосуда Шленка через ртутный затвор. Спустя 2—3 час. кипячения выделение бромистого водорода прекращается (поглотительная склянка не нагревается и в ней больше не видны конвекционные потоки (примечание 1)). После этого сосуд Шленка отсоединяют и закрывают пробкой.
Полученный раствор по результатам титрования имеет концентрацию 0,70—0,75 моль/л, что соответствует выходу бромоводорода в 70—75%. Эфирные растворы бромистого водорода относительно стойки при хранении при -25° (морозильная камера). По оценке, за 100 дней хранения лишь около половины HBr превращается в бромистый этил и этанол.
Примечания
1. В английском оригинале: schlieren. Этим словом описывается оптическое явление, сопровождающее, к примеру, растворение хлороводорода в воде.
(Пер. с англ. Bitrex)
Метод получения 2:
Источник информации: Карякин Ю.В., Ангелов И.И. Чистые химические вещества. - М., 1974 стр. 165-1662P + 3Br2 + 6H2O → 6HBr + 2H3PO3
В колбу помещают 10 г красного фосфора, 20 мл воды и из капельной воронки постепенно приливают (под тягой) 35 мл брома. Выделяющийся газ для очистки пропускают через U-образную трубку, наполненную смесью асбеста с влажным (но не мокрым) красным фосфором.
Выход около 30 л бромоводорода.
Метод получения 3:
Источник информации: Карякин Ю.В., Ангелов И.И. Чистые химические вещества. - М., 1974 стр. 166Br2 + H2S → 2HBr + S
В стеклянный цилиндр с пробкой наливают бром, добавляют немного воды и пропускают сероводород. Выделяющийся газ пропускают серез промывную склянку с суспензией красного фосфора в воде для поглощения унесенного брома.
Газ совершенно не содержит сероводорода и получается достаточно чистым даже при быстром пропускании сероводорода.
Метод получения 4:
Источник информации: Синтезы органических препаратов. - Ч. 1. - М., 1949 стр. 109, 115-116Br2 + 2H2O + SO2 → 2HBr + H2SO4
Бромистоводородная кислота легко получается действием двуокиси серы на бром в присутствии воды (примечание 7).
В 3-литровой круглодонной колбе смешивают 1200 г (377 мл, 7,5 мол.) брома, 500 мл воды и 1500 г измельченного льда. Через смесь пропускают из баллона сильную струю сернистого газа, причем газоприводящая трубка должна оканчиваться ниже поверхности слоя брома. Сернистый ангидрид пропускают с такой скоростью, чтобы газ полностью поглощался. Во время первой стадии восстановления рекомендуется время от времени взбалтывать смесь (примечание 8). По истечении приблизительно 2-х час. восстановление заканчивается, смесь становится желтой (примечание 9), причем окраска не изменяется при дальнейшем пропускании сернистого газа, избытка которого следует избегать (примечание 10). Чтобы предотвратить потерю газообразного бромистого водорода, рекомендуется во время восстановления реакционную смесь охлаждать.
По окончании процесса восстановления колбу соединяют с нисходящим холодильником и смесь подвергают перегонке. Температура кипения постоянно кипящей бромистоводородной кислоты равна 125—126°/760 мм, однако следует помнить, что при отгонке продукта от смеси с серной кислотой показания термометра не дают возможности судить о составе дестиллата. К концу перегонки, когда вода, содержащая лишь следы бромистого водорода, отгоняется от остатка серной кислоты, термометр может показать температуру до 130° и выше. При повторной перегонке продукта показания термометра соответствуют составу дестиллата. При получении большинства (алкил)бромидов не требуется бромистоводородной кислоты, не содержащей следов серной кислоты; в таких случаях достаточно одной перегонки, течение которой контролируют, определяя удельный вес дестиллата.
По описанному способу из 10,3 кг брома получается 20 кг 48%-ной бромисговодородной кислоты (92% теоретич.). Для приготовления указанного количества кислоты один человек должен затратить 23 часа.
При получении бромистых алкилов в сравнительно большом масштабе бромистоводородную кислоту можно не перегонять, а пользоваться ею непосредственно. Тот факт, что на каждый моль бромистоводородной кислоты в смеси находится 0,5 моля серной кислоты, не является недостатком, так как для этого синтеза как раз требуется серная кислота; в таких случаях ее берут соответственно меньше.
Примечания

7. При восстановлении брома сернистым газом следует иметь в виду, что количество взятой воды должно зависеть от того, будет ли после восстановления полученная смесь перегоняться с целью получения 48%-ной бромистоводородной кислоты или же она будет непосредственно применяться для получения алкилбромидов.
8. Во время первой стадии восстановления колбу с реакционной смесью следует время от времени взбалтывать, чтобы избежать накопления сернистого ангидрида или могущего образоваться бромистого сульфурила, вследствие чего реакция внезапно может пойти слишком бурно. При проверке было сделано более 100 опытов по восстановлению брома, количество которого составляло от 0,5 до 2 кг; при этом бурная реакция наблюдалась только в одном или двух случаях, несмотря на то, что жидкость перемешивалась только поступающим газом.
Механическое перемешивание часто является весьма важным фактором для получения хороших выходов. На рис. 5 А и В изображают два типа приспособлений для размешивания, удобных в тех случаях, когда реакционную смесь требуется одновременно кипятить с обратным холодильником. Если величина горла колбы не позволяет установить рядом мешалку и холодильник, то применяют Y-образную трубку (рогатый форштосс), изображенную на рис. 6, В, в которую можно вставить мешалку любой формы. Часто бывает необходимо снабдить колбу, кроме мешалки и обратного холодильника, капельной воронкой или термометром. В этом случае очень удобно пользоваться колбой типа, изображенного на рис. 6, А; среднее горло предназначено для мешалки, а оба боковых — для термометра и обратного холодильника.
9. Яркость окраски восстановленного раствора брома зависит, до некоторой степени, от качества брома. При применении технического продукта особо тщательно необходимо следить за наступлением конца восстановления, т. е. за переходом от окраски, свойственной брому, к желтовато-коричневому цвету.
10. Избытка сернистого ангидрида следует избегать, так как он выделяется во время перегонки и увлекает с собой значительное количество бромистого алкила. Эти потери бывают особенно заметными при получении бромистых этила и аллила, если не соблюдать указанной выше предосторожности.
Способы получения:
- Реакцией брома с парами воды и железными стружками. [Лит.]
- Реакцией брома с водородом при 200-300 С на платинированном асбесте. [Лит.]
- Реакцией брома и красного фосфора с водой. [Лит.]
- Гидролизом бромида железа(III) водяным паром при 350-380 С. [Лит.]
- Бромоводород можно получить реакцией тетрагидронафталина с бромом. Выход 94%. [Лит.1
 ]
]
C10H12 + 4Br2 → C10H8Br4 + 4HBr
- Бромоводород можно получить реакцией водорода с бромом над платиной нанесенной на силикагель при 375 С. [Лит.1
 ]
]
H2 + Br2 → 2HBr
- Азеотроп бромоводорода с водой можно получить отгонкой из холодной смеси бромида калия, воды и серной кислоты после фильтрования сульфата калия. [Лит.1
 ]
]
2KBr + H2SO4 → 2HBr + K2SO4
Реакции вещества:
- 1-Гексин присоединяет бромоводород в присутствии бромида тетраэтиламмония в дихлорметане с образованием 2-бромгекс-1-ена. Выход 89%. [Лит.1]
CH3(CH2)3C≡CH + HBr → CH3(CH2)3CBr=CH2
- Пропаргиловый спирт присоединяет бромоводород в присутствии бромида тетраэтиламмония в дихлорметане с образованием 2-бромпроп-2-ен-1-ола, с примесью 3-бромпроп-2-ен-1-ола. Выход 91%. [Лит.1]
HOCH2C≡CH + HBr → HOCH2CBr=CH2
- Трибромсилан получают реакцией кремния с бромоводородом при нагревании. [Лит.1
 ]
]
Si + 3HBr → SiHBr3 + H2
- Тионилбромид получают реакцией тионилхлорида с бромоводородом. [Лит.1
 ]
]
SOCl2 + 2HBr → SOBr2 + 2HCl
- Бромид хромила с примесью хлорида хромила можно получить реакцией хлорида хромила с жидким безводным бромоводородом. [Лит.1
 ]
]
CrO2Cl2 + 2HBr → CrO2Br2 + 2HCl
- Ди-трет-бутилпероксид реагирует с бромоводородом при 0 С с образованием 1,2-дибром-2-метилпропана. Выход 64%. [Лит.1]
- При 0 С триоксид серы реагирует с бромоводородом с образованием диоксида серы, брома и серной кислоты. [Лит.1]
- Порошок золота растворяется в смеси диметилсульфоксида с бромоводородной кислотой при нагревании 2-4 часа или при выдерживании в течение недели при комнатной температуре с образованием ряда тетрабромауратных солей. [Лит.1]
Реакции, в которых вещество не участвует:
- Ванадий не реагирует с соляной, бромоводородной и холодной серной кислотами. [Лит.1]
- Тантал устойчив к газообразному бромоводороду до 375 С. [Лит.1]
Свойства растворов:
1% (вес.), растворитель - вода
Плотность (г/см3) = 1,0053 (20°)
2% (вес.), растворитель - вода
Плотность (г/см3) = 1,0124 (20°)
10% (вес.), растворитель - вода
Плотность (г/см3) = 1,0723 (20°)
Электропроводность (мСм/см) = 354,9 (15°)
15% (вес.), растворитель - вода
Электропроводность (мСм/см) = 494 (15°)
20% (вес.), растворитель - вода
Плотность (г/см3) = 1,1579 (20°)
30% (вес.), растворитель - вода
Плотность (г/см3) = 1,258 (20°)
39,4% (вес.), растворитель - вода
Температура замерзания (°C) = -89,6
40% (вес.), растворитель - вода
Плотность (г/см3) = 1,3772 (20°)
45% (вес.), растворитель - вода
Плотность (г/см3) = 1,4446 (20°)
50% (вес.), растворитель - вода
Плотность (г/см3) = 1,5173 (20°)
60% (вес.), растворитель - вода
Плотность (г/см3) = 1,6787 (20°)
65% (вес.), растворитель - вода
Плотность (г/см3) = 1,7675 (20°)
Показатели диссоциации:
H0 (1) = -10 (25°C)
H0 (1) = -4,85 (25°C, вода, 56% водный раствор)
pKa (1) = -9 (25°C, вода)
pKa (1) = 5,6 (25°C, уксусная кислота)
Диэлектрическая проницаемость:
6,3 (-80°C)
1,0028 (21°C)
Дипольный момент молекулы (в дебаях):
0,79 (20°C)
Скорость звука в веществе (в м/с):
200 (0°C, состояние среды - газ)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-34,1 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-51,2 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
198,6 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
28,01 (г)Энтальпия плавления ΔHпл (кДж/моль):
2,41Энтальпия кипения ΔHкип (кДж/моль):
17,61Энтальпия испарения ΔHисп (кДж/моль)
12,69 (ж) [при 25 С] [Лит.]
Критическая температура (в °C):
89,8Критическое давление (в МПа):
8,51Критическая плотность (в г/см3):
0,807Источники информации:
- Comey A. M., Hahn D. A. A dictionary of Chemical Solubilities Inorganic. - 2 ed. - New York, The MacMillan Company, 1921. - С. 114-115
- Inorganic Syntheses. - Vol. 1. - New York and London, 1939. - С. 149-157
- Olah G.A., Prakash G.K.S., Molnar A., Sommer J. Superacid chemistry. - 2ed. - Wiley, 2009. - С. 62
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 568-569
- Девятых Г.Г., Зорин А.Д. Летучие неорганические гидриды особой чистоты. - М.: Наука, 1974. - С. 179-190
- Неводные растворители. - М.: Химия, 1971. - С. 81
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 57
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 345
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 996-998
- Справочник химика. - Т. 3. - М.-Л.: Химия, 1965. - С. 78
- Справочник химика. - Т. 3. - М.-Л.: Химия, 1965. - С. 367, 452-453
- Успехи химии. - 1966. - Т.35, №11. - С. 1937 (функция кислотности)
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 320
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер


