Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
тетрахлорметан
Синонимы и иностранные названия:
carbon tetrachloride (англ.)
tetrachloromethane (англ.)
ЧХУ (рус.)
углерод четыреххлористый (рус.)
углерода тетрахлорид (рус.)
углеродтетрахлорид (рус.)
фреон 10 (рус.)
хладон 10 (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
CCl4Формула в виде текста:
CCl4Молекулярная масса (в а.е.м.): 153,82
CAS №: 56-23-5
Температура плавления (в °C):
-22,87Температура кипения (в °C):
76,75Температура разложения (в °C):
400Продукты термического разложения:
гексахлорэтан; хлор; тетрахлорэтен; Температурные константы смесей (содержание в весовых процентах):
66 °C (температура кипения азеотропа, давление 1 атм) вода 4,1% тетрахлорметан 95,9%
Растворимость (в г/100 г растворителя или характеристика):
1,1,2-трифтор-1,2,2-трихлорэтан: смешивается [Лит.]
аммиак жидкий: растворим [Лит.]
ацетон: растворим [Лит.]
бензол: смешивается [Лит.]
бром жидкий: растворим [Лит.]
вода: 0,097 (0°C) [Лит.]
вода: 0,083 (10°C) [Лит.]
вода: 0,08 (25°C) [Лит.]
вода: 0,085 (30°C) [Лит.]
диэтиленгликоль: 35,5 (25°C) [Лит.]
диэтиловый эфир: смешивается [Лит.]
муравьиная кислота: 6,95 (25°C) [Лит.]
оксид-трихлорид фосфора(V): растворим [Лит.]
пропиленгликоль: 30,5 (25°C) [Лит.]
сульфолан: смешивается [Лит.]
фтороводород: плохо растворим [Лит.]
хлор жидкий: хорошо растворим [Лит.]
хлороформ: смешивается [Лит.]
хромила хлорид: растворим [Лит.]
этанол: смешивается [Лит.]
этанол 50%: 6,4 (20°C) [Лит.]
этиленгликоль: 6,6 (25°C) [Лит.]
Плотность:
1,668 (-20°C, г/см3, состояние вещества - жидкость)
1,63195 (0°C, г/см3, состояние вещества - жидкость)
1,602 (15°C, г/см3, состояние вещества - жидкость)
1,5954 (20°C, г/см3, состояние вещества - жидкость)
1,5842 (25°C, г/см3, состояние вещества - жидкость)
1,503 (60°C, г/см3, состояние вещества - жидкость)
1,48 (76°C, г/см3, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Температура взрывного разложения (°C): 338
Нормативные документы, связанные с веществом:
- ГОСТ № 31951-2012 "Вода питьевая. Определение содержания летучих галогенорганических соединений газожидкостной хроматографией." (Описание документа: Определение галогенуглеводородов экстракцией гексаном или парофазным анализом в питьевой воде и воде подземных водоисточников.)
- нижняя граница диапазона определения (мг/дм3) в питьевой воде = 0,0006 (парофазным методом)
- верхняя граница диапазона определения (мг/дм3) в питьевой воде = 0,025 (парофазным методом)
- ГОСТ Р № 51392-99 "Вода питьевая. Определение содержания летучих галогенорганических соединений газожидкостной хроматографией" (Описание документа: Анализ воды ГХ после экстракции гексаном или парофазным методом.)
- ГОСТ Р ИСО № 16017-1-2007 "Воздух атмосферный, рабочей зоны и замкнутых помещений. Отбор проб летучих органических соединений при помощи сорбционной трубки с последующей термодесорбцией и газохроматографическим анализом на капиллярных колонках. Часть 1. Отбор проб методом прокачки"
- Гигиенические нормативы (ГН) № 2.1.5.1315-03 "Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования " (Описание документа: ПДК в питьевой воде; Документ устарел.)
- предельно допустимая концентрация (мг/л) в питьевой воде = 0,001
- МУК № 4.1.598-96 "Методические указания по газохроматографическому определению ароматических, серусодержащих, галогенсодержащих веществ, метанола, ацетона и ацетонитрила в атмосферном воздухе"
- МУК № 4.1.618-96 "Методические указания по хромато-масс-спектрометрическому определению летучих органических веществ в атмосферном воздухе"
- ПНД Ф № 14.1:2:4.71-96 "Методика выполнения измерений массовых концентраций летучих галогенорганических соединений в пробах питьевых, природных и сточных вод методом газовой хроматографии"
- Приказ федерального агентства по рыболовству № 20 от 18.01.2010 "Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения" (Описание документа: ПДК для водных объектов, имеющих рыбохозяйственное значение.)
- предельно допустимая концентрация (мг/л) в природной воде = 0,001 (токсикологический показатель)
- Санитарные правила и нормы (СанПиН) № 2.1.4.1074-01 от 26.09.2001 "Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества" (Описание документа: ПДК в воде централизованного водоснабжения; Документ устарел.)
- предельно допустимая концентрация (мг/л) в питьевой воде = 0,006
Метод получения 1:
Источник информации: Evans, L., & Gray, R. Preparation of Certain Polychlorodimethyl Ethers / Journal of Organic Chemistry. - 1958. - Vol. 23, No. 5 стр. 746 [doi: 10.1021/jo01099a602]В 2-литровую трёхгорлую колбу, снабжённую механической мешалкой, обратным холодильником (верх которого присоединён к охлаждаемой льдом ловушке), термометром и трубкой для ввода газа с пористым стеклянным диском, помещают 368 г (2,0 мол.) симм-тетрахлордиметилового эфира и 616 г (4,0 мол.) четырёххлористого углерода. Смесь нагревают до кипения, после чего через стеклянную трубку начинают вводить хлор со скоростью 142 мл/мин. Всего вводят 43 г (0,6 мол.) хлора. Для поддержания кипения колбу приходится постоянно нагревать. Фракционирование реакционной массы даёт фосген, непрореагировавший эфир и 709 г (4,6 мол.) четырёххлористого углерода. Предположительно, избыточный четырёххлористый углерод получается по той же реакции разложения, которая приводит к образованию фосгена. Ни хлороформа, ни более охлорённого эфира получено не было.
Повторение опыта с понижением температуры до 50° и скорости ввода хлора до 100 мл/мин дало после вакуумной перегонки фосген, непрореагировавший эфир и 115% четырёххлористого углерода по отношению к загруженному.
(Пер. с англ. Bitrex)
Метод получения 2:
Источник информации: Промышленные хлорорганические продукты: Справочник. - М.: Химия, 1978 стр. 40-41Четыреххлористый углерод получают хлорированием сероуглерода в присутствии монохлористой серы. В реакционную колбу загружают сероуглерод и S2Cl2 в соотношении, 4-5 частей CS2 к 1 части S2Cl2. В качестве катализатора добавляют железную стружку. Хлор пропускают через реакционную смесь при 30 С до полной конверсии сероуглерода. CCl4 отгоняется из продуктов реакции, затем его нейтрализуют содой и сушат над силикагелем или хлористым кальцием. Выход продукта составляет 99,9% со степенью чистоты более 95%.
Способы получения:
- Дихлорметан хлорируется хлором в жидкой фазе при инициировании, в газовой фазе в объеме или на катализаторе с образованием хлороформа и четыреххлористого углерода. Температура самовоспламенения смеси паров дихлорметана с хлором равна 262 С. Смеси дихлорметана с жидким хлором могут детонировать. [Лит.1, Лит.2, Лит.3]
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
- Метан реагирует с хлором по радикальному механизму давая смесь хлорметана, дихлорметана, трихлорметана и тетрахлорметана. Температура самовоспламенения смеси метана с хлором равна 318 С. [Лит.1, Лит.2]
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
Используется для синтеза веществ:
дифенилметанон
Реакции вещества:
- При 100 С реагирует с тетрафторэтиленом в присутствии хлорида алюминия с образованием 1,1,2,2-тетрафтор-1,3,3,3-тетрахлорпропана. [Лит.]
- Восстанавливается цинком до хлороформа. [Лит.]
- Реагирует с бромидом алюминия при 100 С образуя тетрабромметан. [Лит.]
- При нагревании с оксидом алюминия дает хлорид алюминия и фосген. [Лит.]
- При 800-900 С распадается до хлора и тетрахлорэтилена. [Лит.]
- Фтор бурно, со взрывом реагирует с хлороформом, тетрахлорметаном. [Лит.1]
- Тетраиодметан получают реакцией тетрахлорметана с этилиодидом в присутствии хлорида алюминия. Выход 60%. [Лит.1
 , Лит.2
, Лит.2 ]
]
CCl4 + 4C2H5I → CI4 + 4C2H5Cl
- Сера реагирует с тетрахлорметаном при 200 С с образованием сероуглерода и дихлорида дисеры. Одновременно образуются следы тиофосгена, трихлорметилсульфенилхлорида и бис(трихлорметил)полисульфидов которые, очевидно, являются промежуточными продуктами реакции. В присутствии катализаторов (алюминий, железо, медь или их хлориды, наилучший - порошок железа) реакция идет при 120 С. [Лит.1]
6S + CCl4 → CS2 + 2S2Cl2
- Диэтилфосфит реагирует с тетрахлорметаном и триэтиламином с образованием диэтилхлорфосфата. Выход 81%. [Лит.1]
- Алюминий сильно корродирует в контакте с тетрахлорметаном с образованием гексахлорэтана и выделением тепла. При температуре плавления алюминия реакция протекает со взрывом. Коррозии предшествует индукционный период. Присутствие воды удлиняет индукционный период, но ускоряет коррозию. [Лит.1]
- Медь растворяется в смеси тетрахлорметана и диметилсульфоксида с образованием хлорида бис(диметилсульфоксид)меди(II) и оксида углерода(II). [Лит.1]
- Фторид золота(III) спокойно реагирует с тетрахлорметаном при 40 С. [Лит.1]
- Медь растворяется в смеси тетрахлорметана и водного раствора аммиака с образованием хлоридов аммиачных комплексов меди. Тетрахлорметан при этом восстанавливается в дихлорметан. [Лит.1]
- Смесь метанола с тетрахлорметаном (9:1) быстро растворяет алюминий, магний и цинк. Растворение цинка начинается после 2-часового индукционного периода. [Лит.1]
- Дихлорид галлия реагирует с тетрахлорметаном с образованием черного осадка угля. [Лит.1]
Показатель преломления (для D-линии натрия):
1,4607 (20°C)
Диэлектрическая проницаемость:
2,238 (20°C)
Дипольный момент молекулы (в дебаях):
0 (20°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль)
-132,842 (ж) [Лит.]
-100,416 (г) [Лит.]
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль)
-62,542 (ж) [Лит.]
-58,154 (г) [Лит.]
Стандартная энтропия S (298 К, Дж/(моль·K))
216,187 (ж) [Лит.]
310,228 (г) [Лит.]
Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K))
133,888 (ж) [Лит.]
83,404 (г) [Лит.]
Энтальпия плавления ΔHпл (кДж/моль)
2,56 (т) [Лит.]
Энтальпия кипения ΔHкип (кДж/моль)
29,82 (ж) [Лит.]
Энтальпия испарения ΔHисп (кДж/моль)
32,43 (ж) [25°C] [Лит.]
Графические спектры вещества:
Инфракрасный спектр
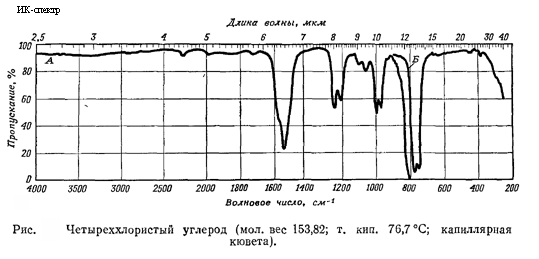
Критическая температура (в °C):
283,2Критическое давление (в МПа):
4,5Применение:
Ранее использовался против кишечного паразита (анкилостомы).
В настоящее время применяется как растворитель, пламегаситель. Большая часть используется для производства фреонов 11 и 12. Глистогонное средство у крупного рогатого скота. Фумигант для протравки зерен.
Дополнительная информация::
Нельзя сушить серной кислотой - образуется высокотоксичный фосген.
Реагирует с бромидом алюминия давая с хорошим выходом тетрабромметан. При нагревании с хлоридом алюминия до 200 С дает розовое окрашивание обусловленное образованием иона трихлоркарбония, который может реагировать с гексаном давая хлороформ.
Источники информации:
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 214-216
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 2-6
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 17-18
- Альберт А. Избирательная токсичность. - Т.2. - М.: Медицина, 1989. - С. 308
- Гордон А., Форд Р. Спутник химика. - М.: Мир, 1976. - С. 187
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 529
- Промышленные хлорорганические продукты: Справочник. - М.: Химия, 1978. - С. 35-44
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 185-186
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 369
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 1021-1041
- Успехи химии. - 1971. - Т.40, №2. - С. 226-253 (реакции с элементоорганическими соединениями)
- Успехи химии. - 1971. - Т.40, №3. - С. 462-490
- Успехи химии. - 1989. - Т.58, №1. - С. 146 (синтез, термическое разложение)
- Химическая энциклопедия. - Т. 5. - М.: Советская энциклопедия, 1999. - С. 392-393
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 688
- Химия и жизнь. - 1990. - №5. - С. 82
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер
