Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
водород
Синонимы и иностранные названия:
hydrogen (англ.)
Вещество входит в группы:
неметаллы
Тип вещества:
неорганическое
Внешний вид:
бесцветн. газ
Внешний вид при разных температурах:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
H2Формула в виде текста:
H2Молекулярная масса (в а.е.м.): 2,01565
Температура плавления (в °C):
-259,19Температура кипения (в °C):
-252,77Температура разложения (в °C):
1700-5000Температура самовоспламенения в воздухе (в °C):
510 [Лит.]
Температуры плавления под давлением (в °C):
100 (7700 МПа)
253 (15000 МПа)
553 (70000 МПа)
Растворимость (в г/100 г растворителя или характеристика):
алюминий расплавленный: растворим [Лит.]
ацетон: 0,00102 (20,9°C) [Лит.]
бензол: 0,00066 (22,9°C) [Лит.]
вода: 0,000194 (0°C) [Лит.]
вода: 0,000175 (10°C) [Лит.]
вода: 0,000164 (20°C) [Лит.]
вода: 0,000157 (25°C) [Лит.]
вода: 0,000153 (30°C) [Лит.]
вода: 0,000147 (40°C) [Лит.]
вода: 0,000145 (50°C) [Лит.]
вода: 0,000144 (60°C) [Лит.]
вода: 0,000144 (100°C) [Лит.]
гексадекафторгептан: 0,000522 (-25°C) [Лит.]
гексадекафторгептан: 0,0006204 (0°C) [Лит.]
гексадекафторгептан: 0,0007287 (25°C) [Лит.]
гексадекафторгептан: 0,0007763 (35°C) [Лит.]
диметилсульфоксид: не растворим [Лит.]
диметилформамид: 0,0004 (25°C) [Лит.]
изобутанол: 0,00105 (20°C) [Лит.]
медь расплавленная: 0,00054 (1083°C) [Лит.]
медь расплавленная: 0,00124 (1550°C) [Лит.]
метанол: 0,00103 (20°C) [Лит.]
метилацетат: 0,000809 (20,9°C) [Лит.]
олово расплавленное: 0,04 (1000°C) [Лит.]
олово расплавленное: 0,036 (1300°C) [Лит.]
тетрахлорметан: 0,000365625 (0°C) [Лит.]
тетрахлорметан: 0,000414562 (20,9°C) [Лит.]
уксусная кислота: 0,000486 (20°C) [Лит.]
хлорбензол: 0,000452 (21,2°C) [Лит.]
хлороформ: 0,000353 (18,7°C) [Лит.]
этанол: 0,000624 (0°C) [Лит.]
этилацетат: 0,000762 (21°C) [Лит.]
Плотность:
0,0763 (-260°C, г/см3, состояние вещества - кристаллы)
0,0768 (-253°C, г/см3, состояние вещества - жидкость)
0,07081 (-252,68°C, г/см3, состояние вещества - жидкость)
0,00008988 (20°C, г/см3, состояние вещества - газ)
Некоторые числовые свойства вещества:
Верхний концентрационный предел взрываемости газов, паров или пыли в воздухе (%): 75
Год открытия: 1766 (Кавендиш Г.)
Магнитная восприимчивость (мм3/кг): -1,9867 (при 20 С)
Нижний концентрационный предел взрываемости газов, паров или пыли в воздухе (%): 4,12
Поляризуемость молекул (нм3): 0,00079
Теплопроводность (Вт/(м·К)): 0,1866 (при 27 С)
Способы получения:
- Реакцией щелочных и щелочноземельных металлов с водой. [Лит.]
- Реакцией магния, цинка, железа с водяным паром при нагревании. [Лит.]
- Реакцией металлов с минеральными кислотами. [Лит.]
- Реакцией угля или углеводородов с парами воды при нагревании. [Лит.]
- Действием кипящего разбавленного раствора перманганата калия на алюминий. [Лит.]
- Реакция алюминия со щелочами. [Лит.]
- Реакцией гидридов щелочных и щелочноземельных металлов с водой. [Лит.]
- Нагреванием кремния с щелочами. [Лит.]
- Калий энергично реагирует с водой, даже при низких температурах (-100 С), с образованием гидроксида калия и водорода. Калий при комнатной температуре воспламеняется и взрывается с водой. Калий сгорает ярким пламенем на льду. [Лит.1]
2K + 2H2O → 2KOH + H2
- Натрий энергично реагирует с водой при комнатной температуре с выделением водорода и образованием гидроксида натрия. При реакции с водой происходит расплавление натрия, при соприкосновении значительных количеств натрия и воды происходит взрыв. Реакция с водой начинается при температуре -98 °С. [Лит.1]
2Na + 2H2O → 2NaOH + H2
- Водород получают пропусканием водяного пара над раскаленным докрасна (900-1000 С) железом. [Лит.1, Лит.2]
Fe + H2O → FeO + H2
- Магний реагирует с горячей водой и водяным паром с выделением водорода и образованием гидроксида магния. [Лит.1]
Mg + 2H2O → Mg(OH)2 + H2
- Гидроксид натрия получают электролизом водного раствора хлорида натрия с диафрагмой или колоколом. При этом происходит выделение хлора и водорода. [Лит.1, Лит.2]
2NaCl + 2H2O → 2NaOH + H2 + Cl2
- Цинк реагирует с щелочами (например, с гидроксидом натрия) с выделением водорода и образованием тетрагидроксоцинката натрия. [Лит.1]
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
- Водород получают реакцией цинка с разбавленной соляной кислотой. [Лит.1]
Zn + 2HCl → ZnCl2 + H2
- Водород получают реакцией цинка с разбавленной серной кислотой. Если концентрация серной кислоты слишком высока, то водород загрязняется диоксидом серы и сероводородом. При использовании не вполне чистого цинка водород может загрязняться фосфином и арсином. При добавлении пентагидрата сульфата меди реакция идет быстрее из-за образования гальванической пары. [Лит.1, Лит.2]
Zn + H2SO4 → ZnSO4 + H2
- Пропусканием водяного пара над коксом при 1000 С получают смесь угарного газа и водорода - так называемый водяной газ. [Лит.1]
C + H2O → CO + H2
- Водород получают электролизом водного раствора гидроксида калия. На катоде выделяется водород, на аноде - кислород. Гидроксид калия используется для увеличения электропроводности раствора. [Лит.1]
2H2O → 2H2 + O2
Реакции вещества:
- Выше 530 °C реагирует с селеном с образованием селеноводорода. [Лит.]
H2 + Se → H2Se
- Выше 730 °С реагирует с теллуром с образованием теллуроводорода. [Лит.]
H2 + Te → H2Te
- Реагирует с хлором на свету с образованием хлороводорода. [Лит.]
H2 + Cl2 → 2HCl
- Реагирует с бис(циклопентадиенил)диметилтитаном в алифатическом углеводороде при комнатной температуре с образованием бис(циклопентадиенил)титана и метана. [Лит.]
- При 2000 К диссоциирует на атомарный водород 0,088% водорода, при 2500 К - 1,31%, 3000 К - 7,85%, 3500 К - 29,6%, 4000 К - 63,9%, 5000 К - 95,5%. [Лит.]
- При 1000°С восстанавливает сульфат бария до сульфида бария. [Лит.]
- При повышенном давлении реагирует с интерметаллидом Ca2Ru с образованием Ca2RuH6. [Лит.]
- Реакцией жидкого водорода с порошком железа при давлении 3,5 ГПа был получен гидрид железа FeH. [Лит.]
- В мягких условиях поглощается интерметаллидом LaNi5, что используется в никель-металлгидридных аккумуляторах. [Лит.]
- При низкой температуре и давлении 1 атм реагирует с темно-пурпурным раствором трикарбонил-бис(трициклогексилфосфин)молибдена в толуоле с образованием желтого осадка (η2-диводород)-трикарбонил-бис(трициклогексилфосфин)молибдена. [Лит.]
- При нагревании выше 400°С водород реагирует с кислородом (около 600°С - с воздухом) с образованием воды. В присутствии катализаторов (платины, соединений родия) реакция может идти при комнатной температуре. Если водород и кислород уже смешаны - реакция идет со взрывом. [Лит.1]
2H2 + O2 → 2H2O
- Скорость реакции фтора с водородом с образованием фтороводорода зависит от стенок сосуда: в кварце реакция происходит даже при температуре жидкого воздуха, в сосудах из серебра и платины реакция медленее, в магниевом сосуде реакция начинается только при температуре выше комнатной. [Лит.1, Лит.2]
H2 + F2 → 2HF
- Калий при 200-400 С реагирует с водородом с образованием гидрида калия. Для большего выхода гидрида калия реакция проводится в избытке водорода при температуре не выше 350 С. [Лит.1]
2K + H2 → 2KH
- При 200 С натрий начинает реагировать с водородом образуя гидрид натрия, а при 300-400 С реакция идет с заметной скоростью. Однако, если не принять мер по диспергированию натрия, то вокруг него образуется пленка гидрида натрия и реакция проходит не полностью. [Лит.1]
2Na + H2 → 2NaH
- Гидрид кальция получают реакцией кальция с водородом при 250-700 С. [Лит.1]
Ca + H2 → CaH2
- Бензол, не содержащий тиофена, гидрируется водородом над никелевым катализатором с образованием циклогексана. Выход 70-80%. [Лит.1, Лит.2
 , Лит.3]
, Лит.3]
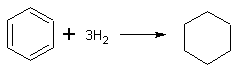
- Толуол гидрируется водородом над никелевым катализатором с образованием метилциклогексана. Выход 86%. [Лит.1
 , Лит.2
, Лит.2 ]
]
C6H5CH3 + 3H2 → C6H11CH3
- Фенол гидрируется водородом в присутствии никелевых катализаторов в циклогексанол. Выход 75%. [Лит.1
 , Лит.2]
, Лит.2]
C6H5OH + 3H2 → C6H11OH
- Оксид меди(II) восстанавливается водородом при 300 С с образованием меди и воды. [Лит.1]
CuO + H2 → Cu + H2O
- Молибден получают восстановлением оксида молибдена(VI) водородом сначала при 500 С, а затем при 1000 С. [Лит.1
 ]
]
MoO3 + 3H2 → Mo + 3H2O
- В присутствии мелкораздробленных платины, палладия или никеля нитрозилхлорид реагирует с водородом с образованием хлорида аммония и азота. [Лит.1]
NOCl + 3H2 → NH4Cl + H2O
2NOCl + 3H2 → N2 + 2H2O + 2HCl
- Ацетилен можно получать в электрической дуге между графитовыми электродами в атмосфере водорода. Выход 8%. [Лит.1]
2C + H2 → C2H2
- Дихлорид дисеры восстанавливается водородом при 150 С в парах до серы и хлороводорода. [Лит.1]
S2Cl2 + H2 → 2S + 2HCl
- Сера медленно реагирует с водородом при 120 С, значительно быстрее при 200 С, с образованием сероводорода. [Лит.1]
S + H2 → H2S
- Дихлорид ванадия образуется при пропускании паров тетрахлорида ванадия с водородом через раскаленную докрасна трубку. [Лит.1]
VCl4 + H2 → VCl2 + 2HCl
- При температуре 170-180 С и выше оксид натрия реагирует с водородом с образованием гидроксида натрия и натрия. [Лит.1, Лит.2]
2Na2O + H2 → 2NaOH + 2Na
- При 400 С и давлении 200 атм, в присутствии железа как катализатора, азот реагирует с водородом с образованием аммиака. [Лит.1, Лит.2]
N2 + 3H2 → 2NH3
- При комнатной температуре водород восстанавливает водные растворы хлорида палладия(II) до металлического палладия. [Лит.1]
H2 + PdCl2 → Pd + 2HCl
- Иодоводород получают реакцией иода с водородом в присутствии платины. [Лит.1
 , Лит.2
, Лит.2 , Лит.3
, Лит.3 , Лит.4
, Лит.4 , Лит.5
, Лит.5 , Лит.6]
, Лит.6]
H2 + I2 → 2HI
- Сжигание водорода в хлоре является важным промышленным способом получения хлороводорода. Температура самовоспламенения смеси водорода и хлора равна 207 С. [Лит.1, Лит.2]
H2 + Cl2 → 2HCl
- Диэтилпероксид восстанавливается водородом на оксиде платины до этанола. [Лит.1]
C2H5OOC2H5 + H2 → 2C2H5OH
- Ди-трет-бутилпероксид восстанавливается водородом под давлением над никелем Ренея до трет-бутанола. [Лит.1]
(CH3)3COOC(CH3)3 + H2 → 2(CH3)3COH
- Реакция восстановления хлорида меди(I) водородом до меди начинается при 230 С и более энергично протекает при 490 С [Лит.1]
2CuCl + H2 → 2Cu + 2HCl
- При комнатной температуре и действии света или при высокой температуре на таких катализаторах, как диоксид марганца, оксид алюминия, хлорид марганца, силикагель, оксид хрома или активированный уголь, нитрозилхлорид реагирует с водородом с образованием хлороводорода и оксида азота(II). [Лит.1]
2NOCl + H2 → 2HCl + 2NO
- Бромоводород можно получить реакцией водорода с бромом над платиной нанесенной на силикагель при 375 С. [Лит.1
 ]
]
H2 + Br2 → 2HBr
- Водород при комнатной температуре реагирует с красным 1-(бис(пентафторфенил)борил)-4-(бис(2,4,6-триметилфенил)фосфинил)-2,3,5,6-тетрафторбензолом с образованием бесцветного цвиттер-ионного фосфоний-борогидридного производного. При нагревании этого производного водород выделяется обратно. [Лит.1]
((CH3)3C6H2)2PC6F4B(C6F5)2 + H2 → ((CH3)3C6H2)2PHC6F4BH(C6F5)2
- Железо можно получить восстанавливая оксид или гидроксид железа(III) водородом при нагревании. При 550-600 С образуется непирофорный порошок железа, ниже 550 С образуется пирофорный порошок железа, при 1000 С получается спеченная масса. [Лит.1
 , Лит.2, Лит.3
, Лит.2, Лит.3 , Лит.4
, Лит.4 , Лит.5
, Лит.5 ]
]
Fe2O3 + 3H2 → 2Fe + 3H2O
- Сурьму можно получить восстановлением оксида сурьмы(III) водородом при 500 С. [Лит.1]
Sb2O3 + 3H2 → 2Sb + 3H2O
- Бромид титана(III) можно получить реакцией бромида титана(IV) с водородом при нагревании. [Лит.1
 ]
]
2TiBr4 + H2 → 2TiBr3 + 2HBr
- Сульфид стронция получают восстановлением сульфата стронция водородом при 980 С. [Лит.1
 , Лит.2
, Лит.2 ]
]
SrSO4 + 4H2 → SrS + 4H2O
- Смесь оксида хлора(I) с водородом при поджиге взрывается. [Лит.1]
Реакции, в которых вещество не участвует:
- При небольшом нагревании калий не реагирует с водородом. Его можно расплавить в атмосфере водорода без заметной реакции. [Лит.1]
- Вольфрам не реагирует с водородом вплоть до температуры плавления. [Лит.1]
- Перхлорилбензол не восстанавливается дихлоридом олова, цинком в соляной кислоте, водородом на палладии, алюмогидридом лития, подкисленным раствором иодида калия. [Лит.1]
- При комнатной температуре в отсутствие света или катализаторов нитрозилхлорид не реагирует с водородом. [Лит.1]
Периоды полураспада:
11H = стабилен (дефект масс 7288,9705 кэВ (содержание в природной смеси изотопов 99,985%))
21H = стабилен (дефект масс 13135,7216 кэВ (содержание в природной смеси изотопов 0,015%))
31H = 12,33 лет (β- (100%); дефект масс 14949,806 кэВ)
41H = 139 иоктосекунд (n (100%); дефект масс 25900 кэВ)
51H = 86 иоктосекунд (2n (100%); дефект масс 32890 кэВ)
61H = 294 иоктосекунды (дефект масс 41880 кэВ)
71H = 652 иоктосекунды (дефект масс 49140 кэВ)
Давление паров (в мм рт.ст.):
1 (-263,6°C)
10 (-261,4°C)
100 (-258,1°C)
Стандартный электродный потенциал:
H2 + 2e- → 2H-, E = -2,251 (вода, 25°C)
2H+ + 2e- → H2, E = 0 (вода, 25°C)
H1 + H+ + e- → H2, E = 2,106 (вода, 25°C)
Показатели диссоциации:
pKa (1) = 39 (25°C, вода)
Диэлектрическая проницаемость:
1,000252 (25°C)
Дипольный момент молекулы (в дебаях):
0 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
0,0087 (-253°C)
0,0085 (0°C)
0,0103 (100°C)
0,0121 (200°C)
0,0154 (400°C)
0,0183 (600°C)
Скорость звука в веществе (в м/с):
1284 (0°C, состояние среды - газ)
1301 (18°C, состояние среды - газ)
1463 (100°C, состояние среды - газ)
Удельная теплоемкость при постоянном давлении (в Дж/г·K):
14,17 (15°C)
14,3 (100°C)
14,49 (200°C)
14,78 (400°C)
15,07 (600°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
0 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
0 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
130,52 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
28,83 (г)Энтальпия плавления ΔHпл (кДж/моль):
0,117Энтальпия кипения ΔHкип (кДж/моль):
0,916Энтальпия диссоциации ΔHдисс (кДж/моль)
435,88 (г) [Лит.]
Некоторые нечисловые свойства вещества:
без запаха
без вкуса
Природные и антропогенные источники:
Содержание в земной коре 0,9% по массе (в виде соединений) всей земной коры и 0,15% если учитывать только горные породы. Свободный водород содержится в вулканических газах и частично образуется при разложении органических веществ. Небольшие количества выделяются зелеными растениями. Содержание в атмосферном воздухе около 0,00005 об%. Некоторую часть водорода атмосфера теряет за счет его улетучивания в космическое пространство.
В космическом пространстве значительно более распространен (88,6% всех атомов), чем на Земле - Солнце на 81,75 ат% состоит из водорода, Юпитер - на 80%, Сатурн - на 60%. В межзвездном пространстве существует в основном в виде атомов.
Критическая температура (в °C):
-239,91Критическое давление (в МПа):
1,297Критическая плотность (в г/см3):
0,031Применение:
Сырье для химической промышленности (напр. производства аммиака, жиров, метанола, хлороводорода, гидридов металлов). Для восстановления окислов в металлургии. Для заполнения шаров-зондов. Ракетное топливо (удельный импульс с кислородом 390 секунд). Для сварки и резки водородным или атомно-водородным пламенем.
История:
В 1671 г Р. Бойль наблюдал выделение горючего газа при действии серной кислоты на железо. Впервые описан в 1766 г Кэвендишем. Название элементу hydrogen дал Лавуазье в 1782 г от греч. "рождающий воду".
В 1866 г Т. Грэм открыл удивительно высокую растворимость водорода в палладии. В 1878 г водород спектроскопически обнаружен в атмосфере Солнца. В 1895 г Дж. Дьюаром получен жидкий водород в количестве достаточном для наблюдения мениска. В 1909 г Сёренсен С. ввел шкалу pH. В 1920 г У. Латимер и У. Роудбуш ввели концепцию водородной связи. В 1924 г Р. Мекке открыты орто- и пара-водород. В 1931 г открыт дейтерий. В 1934 г получен тритий. ЯМР на ядрах водорода впервые наблюдался в 1946 г. В 1950 г тритий обнаружен в атмосферном водороде. В 1954 г была взорвана первая водородная бомба на атолле Бикини. В 1984 г Г. Кубас открыл устойчивые комплексы переходных металлов с дигапто-диводородом (η2-H2).
Дополнительная информация::
Ежегодное мировое потребление превосходит 1000 000 тонн.
Потенциал ионизации атома водорода = 13,595 эВ (313,5 ккал/моль).
Легкость водорода может быть показана в демонстрационном эксперименте наполнением им мыльных пузырей. Характеризуется наибольшей скоростью диффузии и высокой теплопроводностью. Переход в атомарное состояние вызывается также электрическим разрядом или под действием излучения с длиной волны менее 85 нм. Атомарный водород значительно химически активнее молекулярного. Под давлением 0,2 мм.рт.ст. атомарный водород может существовать около 1 секунды. Распад на атомы требует затраты энергии 104,2 ккал/моль при 25 С.
Водород восстанавливает растворы нитрата серебра до металла при обычной температуре. При нагревании восстанавливает многие окислы металлов до свободных металлов. Со фтором соединяется даже в темноте. С азотом под давлением в присутствии катализаторов дает аммиак (процесс Габера). При УФ-облучении реагирует с хлором и бромом. При 1000 С восстанавливает сульфаты до сульфидов.
С кальцием при нагревании образует гидрид.
В присутствии катализаторов гидрирует непредельные органические соединения, альдегиды.
Применение вещества:
- для синтеза аммиака [Лит.]
- для синтеза хлороводорода [Лит.]
- ракетное горючее [Лит.]
Дополнительная информация:
Электронная конфигурация атома 1s1.
Водород, сорбируемый металлами, может оказывать сильное влияние на их механические свойства. Например, палладий, несколько раз нагретый и охлажденный в атмосфере водорода увеличивает свою механическую прочность в 2-4 раза (водородофазовый наклеп), при этом также увеличивается пластичность металла. Интерметаллид LaNi5 циклической термической сорбцией - десорбцией водорода можно превратить в порошок.
В отличие от большинства других газов водород расширяется с разогреванием, а не с охлаждением.
Растворяется в металлах: железе, никеле, палладии, платине, практически не растворим в серебре; растворимость в железе и меди мешает при выплавке этих металлов так как приводит к образованию пустот. Растворимость в железе (объемов водорода на объем железа): 500 С = 0,05, 700 С = 0,14, 900 С = 0,37, 1100 С = 0,55, 1200 С = 0,65, 1350 С = 0,80, 1450 С = 0,87, 1550 С = 2,05.
Смеси водорода с окислителями используются в качестве ракетных топлив. С кислородом достигается температура в камере сгорания 2977 К и удельный импульс 391 с, с диоксидом азота = 2640 К и 341 с, с азотной кислотой = 2474 К и 320 с, с перекисью водорода = 2419 К и 322 с, с фтором = 3988 К и 412 с, с дифторидом кислорода = 3547 К и 412 с, с тетрафторгидразином = 3814 К и 364 с, с трифторидом хлора = 3434 К и 321 с, с пентафторидом хлора = 3705 К и 343 с, с перхлорилфторидом = 3003 К и 344 с.
При повышении давления температура плавления водорода повышается достигая максимума при 70 ГПа и 553 С, затем начинает снижаться, достигая примерно 300 С при 300 ГПа. При 220 ГПа и 300 К водород переходит из фазы I в ионную фазу III и при дальнейшем повышении давления (около 250 ГПа) - в слоистую фазу IV.
Образует больше химических соединений, чем любой другой элемент, включая углерод.
При комнатной температуре водород представляет собой равновесную смесь орто- (75%) и пара-формы (25%). В молекулах ортоводорода (т.пл. -259,20 С, т.кип. -252,76 С) ядерные спины направлены одинаково, а у параводорода (т.пл. -259,32 С, т.кип. -252,89 С) - противоположно друг другу. При низких температурах равновесие между ортоводородом и параводородом сдвинуто в сторону последнего.
Разделить орто- и пара-водород возможно путем адсорбции на активном угле при температуре 20 К.
Источники информации:
- Handbook of Chemistry and Physics. - CRC Press, Inc., 2002. - С. 11-51
- Holleman A.F., Wiberg E., Wiberg N. Lehrbuch der Anorganischen Chemie. - Berlin: Walter de Gruyter, 1995. - С. 238
- Nuclear Physics A. - 2003. - vol.729, Issue 1, 1 December. - С. 27
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 553-567
- The Merck Index 11th ed., Merck & Company, 1989. - С. 759
- Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей. - М.: Наука, 1972. - С. 7-43
- Взаимодействие водорода с металлами. - Авторы: Агеев В.Н., Бекман И.Н. и др., Бурмистрова О.П. - М.: Наука, 1987 (изучение диффузии водорода в металлы)
- Гидриды переходных металлов. - М.: Мир, 1975. - С. 9-15
- Гринвуд Н., Эрншо А. Химия элементов. - Т.1. - М.: БИНОМ. Лаборатория знаний, 2008. - С. 39-53
- Гурвич Я.А. Справочник молодого аппаратчика-химика. - М.: Химия, 1991. - С. 50
- Иванова М.А., Кононова М.А. Химический демонстрационный эксперимент. - М.: Высшая школа, 1969. - С. 12-21
- Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. - М.: Химия, 1981. - С. 465
- Корольченко А.Я., Корольченко Д.А. Пожаровзрывоопасность веществ и материалов и средства их тушения. - 2 изд, Ч.1. - М.: Ассоциация Пожнаука, 2004. - С. 311-312
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 79-82, 115-122
- Неорганическая химия. - Под ред. Третьякова Ю.Д., Т.2. - М.: Academa, 2004. - С. 5-13
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 59
- Реми Г. Курс неорганической химии. - Т.1. - М., 1963. - С. 42-48, 55, 60-65
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 536-553
- Справочник химика. - Т. 3. - М.-Л.: Химия, 1965. - С. 742
- Физические величины. - Под ред. Григорьева И.С., Мейлихова Е.З. - М.: Энергоатомиздат, 1991. - С. 994
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 400-402
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 104
- Химмотология ракетных и реактивных топлив. - Под ред. Браткова А.А. - М.: Химия, 1987. - С. 81-86 (жидкий водород)
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер