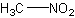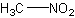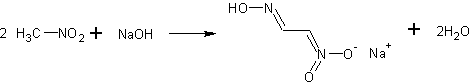Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
нитрометан
Синонимы и иностранные названия:
nitromethane (англ.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
CH3NO2Формула в виде текста:
CH3NO2Молекулярная масса (в а.е.м.): 61,042
CAS №: 75-52-5
Температура плавления (в °C):
-28,55Температура кипения (в °C):
100,8Температурные константы смесей (содержание в весовых процентах):
64,33 °C (температура кипения азеотропа, давление 1 атм) метанол 87,8% нитрометан 12,2%
76 °C (температура кипения азеотропа, давление 1 атм) нитрометан 29% этанол 71%
76,15 °C (температура кипения азеотропа, давление 1 атм, гетерогенный) 1,1,2,2-тетрахлорэтан 7,8% вода 32,3% нитрометан 37,5% октан 11,6% пропан-1-ол 10,8%
83,59 °C (температура кипения азеотропа, давление 1 атм) вода 23,6% нитрометан 76,4%
Растворимость (в г/100 г растворителя или характеристика):
аммиак жидкий: смешивается [Лит.]
ацетон: растворим [Лит.]
вода: 8,676 (20°C) [Лит.]
вода: 9,934 (25°C) [Лит.]
диэтиловый эфир: растворим [Лит.]
этанол: растворим [Лит.]
Плотность:
1,13816 (20°C, г/см3, состояние вещества - жидкость)
Нормативные документы, связанные с веществом:
- Постановление правительства РФ № 681 от 30.06.1998 "Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации" (Описание документа: Списки наркотических и психотропных веществ.)
- список = 4 (прекурсор, таблица III, с концентрацией 40% и более)
Используется для синтеза веществ:
2,4-диметокси-омега-нитростирол
2-(2,5-диметоксифенил)этанамин
Реакции вещества:
- Реагирует с водными растворами щелочей давая метазонат натрия. [Лит.]
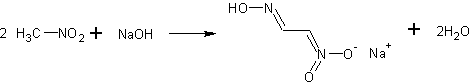
- При действии смеси фосфорного ангидрида и фосфорной кислоты при 190-200 С распадается на муравьиную кислоту и гидроксиламин. [Лит.]
- При перемешивании с водным раствором нитрита натрия в течение 10-15 часов полностью реагирует с образованием карбоната натрия. [Лит.]
- При реакции с концентрированными щелочами при повышенной температуре дает ди-соли нитроуксусной кислоты. [Лит.]
- Конденсируется в течение 50 часов при 25 С с пропаналем в присутствии основной ионнообменной смолы IRA-400 с образованием 1-нитробутан-2-ола. (выход 68%) [Лит.]
- Электровосстановление нитрометана в соляной кислоте дает гидрохлорид N-метилгидроксиламина. Выход 77% (по нитрометану). [Лит.1]
Показатель преломления (для D-линии натрия):
1,3819 (20°C)
Показатели диссоциации:
pKBH+ (1) = -11,9 (25°C, вода)
pKa (1) = 10,21 (25°C, вода)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-112,6 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-14,4 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
171,8 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
106,6 (ж)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-80,8 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
282,9 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
55,5 (г)Летальная доза (ЛД50, в мг/кг):
940 (белые крысы, внутрижелудочно)
950 (мыши, внутрижелудочно)
Анализ вещества:
К раствору 0,2 г нитрометана в 10-кратном объеме воды, прибавляют концентрированный раствор нитрита натрия (1:1), охлаждают до 0 С и осторожно прибавляют к нему разбавленную водой серную кислоту (1:1) - образуется метилнитроловая кислота, и затем при охлаждении - концентрированный раствор едкого кали. Появляется красная окраска раствора.
Нагревают 0,5 мл нитрометана и 1 мл 1 н. раствора едкого кали - смесь окрашивается в желтый цвет. Затем прибаляют несколько капель раствора хлорного железа (при этом выпадает осадок гидроокиси железа) и после охлаждения, по каплям, соляную кислоту - смесь окрашивается в кроваво-красный цвет.
Критическая температура (в °C):
314,8Критическое давление (в МПа):
6,31Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-20
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 36
- Urbanski T. Chemistry and technology of explosives. - vol.1. - Warszawa, 1964. - С. 579-586
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 9
- Гареев Г.А., Свирская Л.Г. Химия нитрометана. - Новосибирск: Наука, 1995
- Гутман В. Химия координационных соединений в неводных растворах. - М.: Мир, 1971. - С. 166-168 (нитрометан как растворитель)
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 565
- Органические реакции. - Сб. 12. - М., 1965. - С. 156
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 167
- Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. - 2-е изд., Ч.1. - М.: Бином. Лаборатория знаний, 2005. - С. 223 (основность)
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 1119
- Справочник химика. - Т. 3. - М.-Л.: Химия, 1965. - С. 367, 379
- Хмельницкий Л.И. Справочник по взрывчатым веществам. - Ч. 2. - М., 1962. - С. 27-35
- Энергетические конденсированные системы. - Под ред. Жукова Б.П., 2-е изд. - М.: Янус-К, 2000. - С. 308-310
- Юрьев Ю. К. Практические работы по органической химии. - вып. 3, 2-е изд. - М., 1964. - С. 68-69
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер