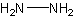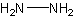Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
гидразин
Синонимы и иностранные названия:
hydrazine (англ.)
Тип вещества:
неорганическое
Внешний вид:
бесцветн. жидкостьКристаллические модификации, структура молекулы, цвет растворов и паров:
В твердом виде - моноклинные кристаллы.
Брутто-формула (по системе Хилла для органических веществ):
H4N2Формула в виде текста:
N2H4Молекулярная масса (в а.е.м.): 32,05
Температура плавления (в °C):
2 [Лит.]
Температура кипения (в °C):
113,5 [Лит.]
Температура вспышки (в °C):
40 [Лит.]
Температура самовоспламенения в воздухе (в °C):
132 [Лит.]
Температурные константы смесей (содержание в весовых процентах):
120 °C (температура кипения азеотропа, давление 1 атм) вода 32,3% гидразин 67,7%
Растворимость (в г/100 г растворителя или характеристика):
аммиак жидкий: смешивается [Лит.]
вода: смешивается [Лит.]
этанол: растворим [Лит.]
Фазовая и многокомпонентная растворимость (в масс%):
(слой 1): вода 13%, гидразин 77,5%, натрия гидроксид 9,3%, (слой 2): вода 29,5%, гидразин 19%, натрия гидроксид 51,4%, 60 °C [Лит.]
Плотность:
1,008 (20°C, г/см3, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Год открытия: 1895 (Лобри-де-Брейн (гидразингидрат был открыт раньше))
Нормативные документы, связанные с веществом:
- ПНД Ф № 14.1:2:4.191-03 "Методика выполнения измерений массовой концентрации гидразина в пробах питьевых, природных и сточных вод газохроматографическим методом"
Метод получения 1:
Источник информации: Гершкович А.А., Кибирев В.К. Синтез пептидов: Реагенты и методы. - Киев: Наукова думка, 1987 стр. 125В двугорлую колбу вместимостью 5 л, снабженную капельной воронкой и обратным холодильником, помещают 2 кг (35 моль) СаО и 2 л толуола. Холодильник закрывают хлоркальциевой трубкой, содержащей едкий натр. Колбу осторожно нагревают на колбонагревателе и медленно в течение 3 ч прибавляют по каплям 1 кг (18 моль) 90 %-ного гидразингидрата. При добавлении реагента толуол начинает кипеть. После того как весь гидразингидрат будет добавлен, реакционную смесь кипятят в течение 10 ч., а затем вместо обратного холодильника ставят насадку Дина - Старка, в которую собирают гидразин с толуолом. Безводный гидразин отделяется в виде нижнего слоя.
Выход 430 г (75 %).
Способы получения:
- Реакцией азотноватистой кислоты с гидросульфитом натрия, с последующим восстановлением цинковой пылью в уксусной кислоте. [Лит.]
- Восстановление нитрамида цинковой пылью в кислом растворе. [Лит.]
- Восстановление калиевой соли N-нитрозогидроксиламин-N-сульфоновой кислоты амальгамой натрия или цинковой пылью в щелочном растворе. [Лит.]
- Восстановление димера 3-метил-3-нитрозо-2-бутанона хлоридом олова(II) в соляной кислоте. [Лит.]
- Восстановление диазоуксусного эфира или сульфатом железа(II) в щелочи или цинком, или алюминием в щелочи. [Лит.]
- Реакция диазоуксусного эфира с гидросульфитом калия с последующим гидролизом образовавшейся соли замещенной гидразинсульфоновой кислоты серной кислотой. [Лит.]
- Димеризация диазоуксусного эфира под действием концентрированных щелочей в тетразиндикарбоновую кислоту, которая под действием кислот расщепляется на щавелевую кислоту и гидразин. Таким образом впервые был получен гидразин. [Лит.]
- Восстановление калиевой соли диазометандисульфоновой кислоты сульфитом калия, с последующим гидролизом продукта восстановления кислотой. [Лит.]
- Восстановление азотистоводородной кислоты цинком в кислой среде в присутствии катализатора. [Лит.]
- Действием фтора на концентрированные растворы аммиака с добавлением желатина. (выход 65%) [Лит.]
- Реакцией избытка аммиака с гипохлоритом натрия при нагревании в присутствии желатина; лучше под давлением аммиака. Это промышленный метод получения гидразина (метод Рашига). [Лит.]
- Реакцией мочевины с гипохлоритом натрия при охлаждении и добавлении мочевины с последующим нагревом. [Лит.]
- Сульфат гидразина реагирует с жидким аммиаком с образованием гидразина и нерастворимого в жидком аммиаке сульфата аммония. Данная реакция используется для получения безводного гидразина. [Лит.1]
(N2H6)SO4 + 2NH3 → (NH4)2SO4 + N2H4
- Азот восстанавливается гидроксидом ванадия(II) в присутствии ионов магния (отношение Mg:V примерно 30) в 1 М растворе щелочи за несколько секунд с образованием гидразина. При атмосферном давлении выход около 20%, при 10 МПа - близок к количественному. [Лит.1]
N2 + 4V(OH)2 + 4H2O → N2H4 + 4V(OH)3
Используется для синтеза веществ:
2,2,6,6-тетраметилпиперидин
Реакции вещества:
- Горит на воздухе синим пламенем. [Лит.]
- Реагирует в щелочной среде с бензальдегидом с образованием бензальазина, из которого могут быть выделены обратно соли гидразина нагреванием с кислотами. [Лит.]
- Реагирует с бензоилхлоридом с образованием 1,2-дибензоилгидразина. (выход 66%) [Лит.]
- При кипячении на водяной бане с фенилмочевиной, в течение 12 часов, образует 4-фенилсемикарбазид. (выход 37%) [Лит.]
- Гидразин во фторе самовоспламеняется. При отношении гидразина ко фтору 1:2 (по массе) температура пламени достигает 4550 К. [Лит.1]
- Тетранитрометан количественно реагирует с гидразином в присутствии гидроксида калия с образованием нитроформата калия и выделением азота. Выход 100%. [Лит.1]
2C(NO2)4 + N2H4 + 4KOH → 2KC(NO2)3 + 2KNO2 + N2 + 4H2O
Давление паров (в мм рт.ст.):
10 (18,9°C)
100 (61,8°C)
Стандартный электродный потенциал:
N2 + 4H2O + 4e- → N2H4 + 4OH-, E = -1,16 (вода, 25°C)
Показатели диссоциации:
pKBH+ (1) = 5,77 (°C, вода)
pKBH+ (2) = -1 (°C, вода)
Диэлектрическая проницаемость:
58 (25°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
1,21 (5°C)
0,91 (25°C)
Поверхностное натяжение (в мН/м):
66,7 (25°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
50,5 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
149,2 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
121 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
98,83 (ж)Энтальпия плавления ΔHпл (кДж/моль):
12,66Энтальпия кипения ΔHкип (кДж/моль)
41,8 (ж) [Лит.]
Энтальпия испарения ΔHисп (кДж/моль)
44,7 (ж) [Лит.]
Летальная доза (ЛД50, в мг/кг):
60 (крысы, внутрижелудочно)
59 (мыши, внутрижелудочно)
Симптомы острого отравления:
Животные. При воздействии паров гидразина (130-760 мг/м3, 2 ч) погибали 1-2 крысы из 6, при 110-400 мг/м3 и 4 ч уже 1-5 из 6. По другим данным, смертельная концентрация для мышей и крыс при 2-часовом отравлении составляет 1000-2000 мг/м3, при 4-часовом ЛК50 для мышей 320 мг/м3, для крыс 740 мг/м3. После ингаляции 20 000 мг/м3 (4 ч) у крыс сильное слюнотечение, резкое возбуждение, судороги.
При введении в желудок ЛД50 для мышей 59 мг/кг, для крыс - 60 мг/кг. Гистологически - жировая инфильтрация печени, дистрофические изменения почек, в легких кровоизлияния и отек. После внутрибрюшинного введения 20-25 мг/кг у крыс нарушалась условнорефлекторная деятельность,у кошек возникали самопроизвольные приступы эпилепсии.
Гидразин легко проникает через неповрежденную кожу собак при аппликации жидкого вещества (3-15 мл/кг) и при воздействии его в парообразном состоянии (100-200 мг/м3); признаки интоксикации аналогичны вышеописанным.
Человек. Концентрация 3,9 мг/м3 переносится 60 минут, 9,1 мг/м3 - 30, 13 мг/м3 - 10 минут. При легких интоксикациях наблюдаются раздражение слизистых оболочек глаз и верхних дыхательных путей, при средних - бронхит и токсический отек легких, возбуждение, а затем депрессия, нарушение углеводной, жировой и антитокисческой функции печени.
Критическая температура (в °C):
380Критическое давление (в МПа):
14,7Источники информации:
- Holleman A.F., Wiberg E., Wiberg N. Lehrbuch der Anorganischen Chemie. - Berlin: Walter de Gruyter, 1995. - С. 675-680
- Urbanski T. Chemistry and technology of explosives. - vol.3. - Warszawa, 1967. - С. 305-308
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.3. - Л.: Химия, 1976. - С. 92-94
- Гутман В. Химия координационных соединений в неводных растворах. - М.: Мир, 1971. - С. 65-67 (жидкий гидразин как растворитель)
- Девяткин В.В., Ляхова Ю.М. Химия для любознательных, или о чем не узнаешь на уроке. - Ярославль: Академия Холдинг, 2000. - С. 55
- Коровин Н.В. Гидразин. - М.: Химия, 1980
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 403-404
- Одрит Л., Огг Б. Химия гидразина. - Нью-Йорк, 1951
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 51
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 912-916
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 547-548
- Химмотология ракетных и реактивных топлив. - Под ред. Браткова А.А. - М.: Химия, 1987. - С. 98-105
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер