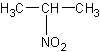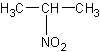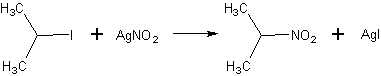Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
2-нитропропан
Синонимы и иностранные названия:
2-nitropropane (англ.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
C3H7NO2Формула в виде текста:
(CH3)2CHNO2Молекулярная масса (в а.е.м.): 89,093
Температура плавления (в °C):
-91,32Температура кипения (в °C):
120,25Температурные константы смесей (содержание в весовых процентах):
88,55 °C (температура кипения азеотропа, давление 1 атм) 2-нитропропан 70,6% вода 29,4%
Растворимость (в г/100 г растворителя или характеристика):
вода: 1,67 (20°C) [Лит.]
вода: 1,78 (25°C) [Лит.]
вода: 2,42 (90°C) [Лит.]
сульфолан: смешивается [Лит.]
хлороформ: растворим [Лит.]
Плотность:
0,9884 (20°C, г/см3, состояние вещества - жидкость)
Метод получения 1:
Источник информации: Агрономов А.Е., Шабаров Ю.С. Лабораторные работы в органическом практикуме. - М., 1974 стр. 88-89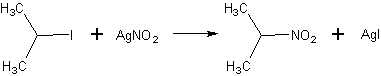
Тщательно смешивают 19 г нитрита серебра с 60 г чистого мелкого песка (обычный песок измельчают и промывают кипятком) и помещают смесь в двухгорлую колбу емкостью 150 мл, снабженную капельной воронкой и обратным холодильником. Затем постепенно добавляют из капельной воронки 21,5 г 2-иодпропана с такой скоростью, чтобы реакционная смесь все время слабо кипела (реакция идет с саморазогреванием: наружного охлаждения не применяют). Для доведения реакции до конца смесь нагревают на водяной бане в течение 30 мин. Затем отставляют баню, дают колбе остыть, заменяют обратный холодильник на нисходящий и отгоняют на водяной бане изопропилнитрит. Удалив водяную баню и насухо вытерев реакционную колбу, нагревают ее на голом пламени для отгонки 2-нитропропана (дистиллят темно-бурого цвета). Полученную фракцию переносят в колбу Фаворского емкостью 15-25 мл с высоким дефлегматором и вторично перегоняют, собирая фракцию с т. кип. 115-118 С. Выход 2-нитропропана около 3,5 г (30% от теоретического); n = 1,3945.
Показатели диссоциации:
pKa (1) = 7,675 (25°C, вода)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-180,3 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
170,3 (ж)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-138,9 (г)Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-24
- Yalkowsky S.H., Yan H., Jain P. Handbook of aqueous solubility data. – 2nd ed. - CRC Press, 2010. - С. 69
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.2. - Л.: Химия, 1976. - С. 212-213
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 167
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер