Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
литий
Синонимы и иностранные названия:
lithium (англ.)
Вещество входит в группы:
металлы
Тип вещества:
неорганическое
Внешний вид:
серебристо-бел. кубические кристаллы металлаКристаллические модификации, структура молекулы, цвет растворов и паров:
 Очень легкий металл - плавает в керосине (на фото). Пары окрашены в ярко-красный цвет.
Очень легкий металл - плавает в керосине (на фото). Пары окрашены в ярко-красный цвет.
Брутто-формула (по системе Хилла для органических веществ):
LiФормула в виде текста:
LiМолекулярная масса (в а.е.м.): 6,94
Температура плавления (в °C):
180,5Температура кипения (в °C):
1390Температурные константы смесей (содержание в весовых процентах):
-184,6 °C (температура плавления эвтектической смеси) аммиак 90,75% литий 9,25%
Растворимость (в г/100 г растворителя или характеристика):
1-пропиламин: не растворим [Лит.]
2-пропиламин: не растворим [Лит.]
алюминий расплавленный: 11 (600°C) [Лит.]
аммиак жидкий: 10,87 (-33,2°C) [Лит.]
вода: реагирует [Лит.]
гексаметилфосфаттриамид: хорошо растворим [Лит.]
гидразин: мало растворим [Лит.]
метиламин: 7,4 (-23°C) [Лит.]
ртуть: 0,09 (18°C) [Лит.]
ртуть: 0,039 (20°C) [Лит.]
ртуть: 0,1 (65°C) [Лит.]
ртуть: 0,11 (89°C) [Лит.]
ртуть: 0,13 (100°C) [Лит.]
хлорид лития расплавленный: 0,2 (650°C) [Лит.]
этиламин: растворим [Лит.]
этилендиамин: 0,223 (20°C) [Лит.]
Плотность:
0,534 (20°C, г/см3, состояние вещества - кристаллы)
0,507 (200°C, г/см3, состояние вещества - жидкость)
0,49 (400°C, г/см3, состояние вещества - жидкость)
0,474 (600°C, г/см3, состояние вещества - жидкость)
0,457 (800°C, г/см3, состояние вещества - жидкость)
0,441 (1000°C, г/см3, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Год выделения чистого вещества: 1818 (Дэви Г.)
Год открытия: 1817 (Арфведсон А.)
Скорость выгорания со свободной поверхности (кг/(м2·ч)): 50,4
Твердость по шкале Мооса: 0,6
Нормативные документы, связанные с веществом:
- ГОСТ Р № 57165-2016 "Вода. Определение содержания элементов методом атомно-эмиссионной спектрометрии с индуктивно связанной плазмой"
Метод получения 1:
Источник информации: Ключников Н.Г. Неорганический синтез. - М., 1988 стр. 85
Для получения металлического лития проводят электролиз раствора хлорида лития в безводном пиридине. Для обезвоживания хлорид прокаливают при 550-600°С, пиридин настаивают с сухим гидроксидом калия и с силикагелем-осушителем, а затем перегоняют. При 20°С в пиридине растворяется 11,81% хлорида лития. Электролиз проводят в ванне без диафрагмы с катодом в виде железной пластинки площадью 4-5 см2, анод - угольный стержень. Плотность тока 0,2-0,3 А/дм2. Напряжение на ванне зависит от расстояния между электродами и степени обезвоживания исходных веществ. Литий получается в виде серебристо-белого слоя, плотно приставшего к катоду. Его промывают эфиром, очищают скальпелем и быстро запаивают в ампуле. Литий можно хранить в хорошо закрытой пробирке, доверху наполненной керосином, бензином или петролейным эфиром (он в них всплывает!).
Метод очистки или выделения из смесей 1:
Источник информации: Редкие и рассеянные элементы. Химия и технология. - Кн. 1. - М.: Мисис, 1996 стр. 68От механических частиц литий очищают пропусканием расплава через сетчатые фильтры из титановой, железной или молибденовой проволоки.
Кислород и азот удаляют из расплавленного лития геттерами - порошкообразными или губчатыми титаном или цирконием.
От натрия и калия литий очищают переводом его в гидрид лития при 700-800 С (при этой температуре гидриды натрия и калия неустойчивы), с отгонкой металлических натрия и калия и последующим разложением гидрида лития в вакууме. Также пригодна вакуумная дистилляция.
Способы получения:
- Электролиз растворов солей лития в ацетоне, ацетонитриле, формамиде, диметилформамиде, диметилсульфоксиде, диметилацетамиде, диэтилформамиде, тетрагидрофуране или ацетонитриле. [Лит.]
- Электролиз расплава смеси хлоридов лития и калия при температуре 400-430 С. [Лит.]
- Восстановление смеси оксидов лития и кальция кремнием до лития и ортосиликата кальция. [Лит.]
- Восстановление смеси оксидов лития и кальция алюминием до лития и алюминатов кальция. [Лит.]
- Вакуумное восстановление сподумена в смеси с карбонатом кальция алюминием или ферросилицием. [Лит.]
Реакции вещества:
- Реагирует с расплавленной серой давая сульфид лития. [Лит.]
2Li + S → Li2S
- При нагревании реагирует с иодом с образованием иодида лития. [Лит.]
2Li + I2 → 2LiI
- Спокойно реагирует с водой с образованием гидроксида лития и водорода, расплавленный литий взрывает с водой. [Лит.]
2Li + 2H2O → 2LiOH + H2
- Медленно реагирует с жидким аммиаком (катализатор - вода) с образованием амида лития и водорода. [Лит.]
2Li + 2NH3 → 2LiNH2 + H2
- Выше 400°С реагирует с водородом с образованием гидрида лития. При 710-720°С реакция протекает особенно бурно. [Лит.]
2Li + H2 → 2LiH
- При комнатной температуре медленно реагирует с диоксидом углерода. Расплавленный металл горит с атмосфере диоксида углерода. [Лит.]
- Смеси литиевых стружек с некоторыми галогенуглеводородами (CHBr3, CBr4, CCl4, CI4, CHCl3, CH2Cl2, CH2I2, CFCl3, C2Cl4, C2HCl3) обладают детонационными свойствами. [Лит.]
- С ртутью дает амальгаму с большим выделением тепла. [Лит.]
- С разбавленными минеральными кислотами реагирует бурно давая соли и водород. [Лит.]
- С серебром, ртутью, магнием, цинком, таллием, алюминием, свинцом, висмутом образует интерметаллиды. [Лит.]
- Реагирует с дибутилртутью в эфире с образованием бутиллития и ртути. [Лит.]
- Реакция с реактивами Гриньяра идет очень медленно. Реакция утратила синтетическое значение. [Лит.]
- Реагирует с кремнием в нейтральной среде при 185-200°С с образованием силицидов лития. [Лит.]
- Воспламеняется в парах брома и иода. [Лит.]
- Воспламеняется в хлоре в присутствии влаги. [Лит.]
- Медленно реагирует с концентрированной серной кислотой. [Лит.]
- Энергично реагирует с концентрированной соляной кислотой. [Лит.]
- Реагирует с концентрированной азотной кислотой плавясь и воспламеняясь. [Лит.]
- Очень слабо взаимодействует с газообразными галогеноводородами при комнатной температуре, но при повышении температуры скорость реакции возрастает. Образуется галогенид лития и водород. [Лит.]
- Интенсивно, но медленнее чем с водой, реагирует с этанолом образуя этанолат лития и водород. [Лит.]
- Спокойно реагирует с бутиловым спиртом. [Лит.]
- При комнатной температуре литий медленно, при небольшом нагревании - быстрее, реагирует с азотом с образованием нитрида лития. Особенно энергично, с воспламенением, реакция идет при 450-460°С. [Лит.1, Лит.2
 ]
]
6Li + N2 → 2Li3N
- Литий на воздухе загорается с трудом. Продукты коррозии лития воспламеняются при 200 С. Чистый рафинированный металл воспламеняется при 640 С. Литий загорается сначала в одной точке, затем пламя распространяется на всю поверхность. Удаление очага загорания прекращает горение лития. Горит спокойным ярко-белым пламенем с густыми клубами белого дыма оксида лития. [Лит.1]
4Li + O2 → 2Li2O
- При нагревании литий горит голубым пламенем в кислороде с образованием оксида лития. [Лит.1]
4Li + O2 → 2Li2O
- Ацетиленид дилития можно получить реакцией лития с ацетиленом в жидком аммиаке, с последующим термическим разложением ацетиленида монолития. Продукт всегда содержит примесь ацетиленида монолития. [Лит.1
 ]
]
2Li + 2C2H2 → 2LiC2H + H2
2LiC2H → Li2C2 + C2H2
- Бутиллитий получают из лития и бутилбромида в диэтиловом эфире при добавлении 0,05-0,5% натрия. Если литий тщательно очищен от натрия или натрий не сплавлен с литием выход падает в 2 раза. Выход 80-95%. [Лит.1]
CH3CH2CH2CH2Br + 2Li → CH3CH2CH2CH2Li + LiBr
- Ацетиленид лития получают реакцией лития с сажей при 600-700 С в вакууме в течение 30 минут. [Лит.1
 ]
]
2Li + 2C → Li2C2
- Нафталин восстанавливается литием в смеси жидких диметиламина и этиламина с образованием смеси 1,2,3,4,5,6,7,8-октагидронафталина и 1,2,3,4,4a,5,6,7-октагидронафталина. Для удаления второго продукта используют присоединение к нему диалкилборана с окислением в спирт. Выход 50-54%. [Лит.1]
- Циклопентан можно получить реакцией 1,5-дибромпентана с амальгамой лития в диоксане. Выход 75%. [Лит.1]
- 3-Октин восстанавливается литием в этиламине при -78 С в транс-3-октен. Выход 52%. [Лит.1]
- п-Толуидин восстанавливается литием в этиламине за 6 часов в 4-метилциклогексиламин. Выход 50%. [Лит.1]
- Стеароловая кислота восстанавливается литием с жидким аммиаком в тетрагидрофуране в автоклаве при комнатной температуре до элаидиновой кислоты. Выход 97,5%. [Лит.1]
- Натрий и литий всплывают в хромилхлориде покрываясь слоем солей, которые прекращают дальнейшую реакцию. [Лит.1]
- Толуол восстанавливается 4 эквивалентами лития в жидком метиламине с образованием смеси 1-метилциклогексена (59%) и 3- и 4-метилциклогексенов (41%). Добавление диметиламина увеличивает долю 1-метилциклогексена в продуктах реакции. [Лит.1]
- 5-Децин восстанавливается литием в этиламине при -78 С в транс-5-децен. [Лит.1]
Реакции, в которых вещество не участвует:
- Не реагирует с парафиновыми углеводородами, простыми эфирами, бензолом, бензином, керосином, инертными газами. [Лит.]
- Хорошая коррозионная стойкость в расплавленном литии у чистого железа. [Лит.]
- Хорошая коррозионная стойкость в расплавленном литии у ниобия, тантала, молибдена. [Лит.]
Периоды полураспада:
103Li = 3,1 зс (2n (100%))
113Li = 8,4 мс (β-)
123Li = менее 10 нс ()
43Li = 91 иоктосекунда (p)
53Li = 370 иоктосекунд (p)
63Li = стабилен (дефект масс 14086,79 кэВ (содержание в природной смеси изотопов 7,5%))
73Li = стабилен (дефект масс 14908,14 кэВ (содержание в природной смеси изотопов 92,5%))
83Li = 0,84 с (β-)
93Li = 0,178 с (β-)
Давление паров (в мм рт.ст.):
0,00776 (527°C)
1 (732°C)
5 (828°C)
20 (940°C)
40 (1003°C)
60 (1042°C)
100 (1097°C)
200 (1178°C)
400 (1232°C)
Свойства растворов:
1,37% (вес.), растворитель - аммиак жидкий
Плотность (г/см3) = 0,639 (-33,2°)
5,17% (вес.), растворитель - аммиак жидкий
Плотность (г/см3) = 0,554 (-33,2°)
10,73% (вес.), растворитель - аммиак жидкий
Плотность (г/см3) = 0,49 (-33,2°, насыщенный раствор)
Стандартный электродный потенциал:
Li+ + e- → Li, E = -3,48 (муравьиная кислота, 25°C)
Li+ + e- → Li, E = -3,23 (ацетонитрил, 25°C)
Li+ + e- → Li, E = -3,095 (метанол, 25°C)
Li+ + e- → Li, E = -3,045 (вода, 25°C)
Li+ + e- → Li, E = -3,04 (этанол, 25°C)
Li+ + e- → Li, E = -2,24 (аммиак жидкий, -50°C)
Li+ + Hg + e- → Li(Hg), E = -2 (вода, 25°C)
Удельная теплоемкость при постоянном давлении (в Дж/г·K):
3,4122 (25°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
0 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
0 (т)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
29,1 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
24,63 (т)Энтальпия плавления ΔHпл (кДж/моль):
4,2Стандартная энтальпия образования ΔH (298 К, кДж/моль):
2,4 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
34 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
31,3 (ж)Энтальпия кипения ΔHкип (кДж/моль):
138Стандартная энтальпия образования ΔH (298 К, кДж/моль):
159,3 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
138,7 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
20,79 (г)Природные и антропогенные источники:
Распространенность элемента в земной коре 0,0018%. В природе встречается только в виде соединений. Наиболее важный минерал - сподумен LiAlSi2O6.
Мировое производство соединений лития в 1994 г составило, в пересчете на металл, 5700 т. Мировое производство самого металла в настоящее время составляет около 1000 т.
Информация из сети Интернет или других непостоянных источников:
Хранят литий, вдавливая прутики из него в мягкий парафин или вазелин.
В литературе наблюдается путаница в реакциях лития с воздухом. Сначала пишут, что при содержании кислорода более 14% реакция с азотом останавливается, а ниже пишут, что основной продукт коррозии на воздухе - нитрид, а чуть позже пишут, что при сгорании образуется оксид.
При горении на воздухе описывается разный цвет пламени (белый, голубой, красный). Судя по видеороликам цвет пламени - белый.
[Замечания автора базы, Руслана Кипера]
Анализ вещества:
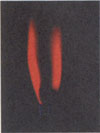 Соли лития окрашивают пламя в карминово-красный цвет (на фото).
Соли лития окрашивают пламя в карминово-красный цвет (на фото).
Применение:
Используется для производства высокопрочных легких алюминиевых сплавов. Сплав с магнием используется для изготовления бронированных пластин и элементов космических аппаратов.
Дополнительная информация::
Реагирует с кислородом при 100 С с образованием оксида. Непосредственно соединяется с фтором.
С алкил- и арилгалогенидами в петролейном или диэтиловом эфире дает литийорганические соединения.
Этимология названия:
От греческого литос - камень.
Применение вещества:
- для производства литиевых аккумуляторов [Лит.]
Дополнительная информация:
Электронная конфигурация атома лития 1s22s1.
Природные изотопы лития 6 и 7 можно разделять используя обмен между растворами солей лития и амальгамой лития (коэффициент разделения 1,023-1,068), экстракцией солей в органические растворители (коэффициент разделения 1,004-1,014), экстракцией солей лития в виде комплексов с краун-эфирами (коэффициент разделения до 1,18), ионообменными методами (коэффициент разделения 1,0010-1,024).
Пары лития имеют ярко-красный цвет. Летучие соединения лития окрашивают пламя горелки в в краминово-красный цвет, что используется для качественного обнаружения элемента.
Расплавленный литий растворяет металлы и обезуглероживает стали, что приводит к изменению прочности конструкционных материалов.
Расплавленный литий не растворяет инертные газы.
Литий смешивается с натрием только выше 380 С, не смешивается с расплавленными калием, рубидием и цезием.
Аномально низкий стандартный электродный потенциал лития в воде, не соответствующий его реальной химической активности, является следствием высокой энергии и энтропии гидратации иона лития, которая обусловлена высокой плотностью заряда на ионе.
Растворяется в жидком аммиаке с образованием синего раствора с металлической проводимостью.
Источники информации:
- Comey A. M., Hahn D. A. A dictionary of Chemical Solubilities Inorganic. - 2 ed. - New York, The MacMillan Company, 1921. - С. 454
- Handbook of Chemistry and Physics. - CRC Press, Inc., 2002. - С. 11-51
- Герасимов Я.И., Древинг В.П., Еремин Е.Н.. Киселев А.В., Лебедев В.П., Панченков Г.М., Шлыгин А.И. Курс физической химии. - Т.2. - М.: Химия, 1973. - С. 528
- Гринвуд Н., Эрншо А. Химия элементов. - Т.1. - М.: БИНОМ. Лаборатория знаний, 2008. - С. 75-76, 81, 83
- Гришин В.К., Глазунов М.Г., Аракелов А.Г., Вольдейт А.В., Македонская Г.С. Свойства лития. - М.: ГНТИЛЧЦМ, 1963
- Гурвич Я.А. Справочник молодого аппаратчика-химика. - М.: Химия, 1991. - С. 51, 303
- Девяткин В.В., Ляхова Ю.М. Химия для любознательных, или о чем не узнаешь на уроке. - Ярославль: Академия Холдинг, 2000. - С. 83
- Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. - Ч.2. - М.: Мир, 1969. - С. 62
- Кулифеев В.К., Миклушевский В.В., Ватулин И.И. Литий. - М.: Мисис, 2006. - С. 17-24
- Неорганические синтезы. - Сб. 1. - М.: ИИЛ, 1951. - С. 10
- Новый справочник химика и технолога. Химическое равновесие. Свойства растворов. - СПб.: НПО Профессионал, 2004, 2007. - С. 400 (растворимость в аммиаке)
- Остроушко Ю.И., Бучихин П.И. и др. Литий, его химия и технология. - М.: ИГУИАЭ, 1960. - С. 34-40
- Плющев В.Е., Степин Б.Д. Химия и технология соединений лития, рубидия и цезия. - М.: Химия, 1970. - С. 11-17
- Свойства элементов. - под общей редакцией Дрица М.Е. - М.: Металлургия, 1985. - С. 29-36
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 590
- Физические величины. - Под ред. Григорьева И.С., Мейлихова Е.З. - М.: Энергоатомиздат, 1991. - С. 994
- Химическая энциклопедия. - Т. 2. - М.: Советская энциклопедия, 1990. - С. 605-606
- Химия и технология редких и рассеянных элементов. - Ч. 1. - М.: Высшая школа, 1976. - С. 7-9
- Энциклопедия для детей. - Т.17: Химия. - М.: Аванта+, 2004. - С. 186-188
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер
 Очень легкий металл - плавает в керосине (на фото). Пары окрашены в ярко-красный цвет.
Очень легкий металл - плавает в керосине (на фото). Пары окрашены в ярко-красный цвет. Очень легкий металл - плавает в керосине (на фото). Пары окрашены в ярко-красный цвет.
Очень легкий металл - плавает в керосине (на фото). Пары окрашены в ярко-красный цвет.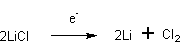
 Соли лития окрашивают пламя в карминово-красный цвет (на фото).
Соли лития окрашивают пламя в карминово-красный цвет (на фото).