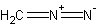
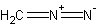
К раствору 3,10 моля сернокислого метиламина-С13 в 2 мл воды прибавляют 0,6 г цианата натрия и несколько капель 0,1 н. серной кислоты, после чего раствор кипятят с обратным холодильником в течение 15 мин. Смесь метил-С13-мочевины (примечание 2) подкисляют при перемешивании при температуре —5°С 3,5 мл 2,75 н. серной кислоты, а затем обрабатывают на холоду 0,5 г нитрита натрия, прибавляя его порциями в течение 1 часа. Добавляют эфир и трижды экстрагируют водную фракцию холодным эфиром (примечание 3). Объединяют эфирные вытяжки 1-метил-С13-1-нитрозомочевины и прибавляют их к охлажденному 10 н. раствору едкого натра (примечание 4); полученный эфирный раствор диазометана-С13 перегоняют в ловушку, охлаждаемую до —78°С (примечание 5). Выход диазометана-С13 (3,56 моля, 57%) определяют, обрабатывая раствор взвешенными порциями .мезодибромянтарной кислоты (0,51 г, 1,78 мэкв) до почти полного исчезновения желтой окраски (примечание 6). В процессе синтеза изотопного разбавления не происходит (примечание 7).
Примечания
2. Джонс получил метил-С14-мочевину с количественным выходом из солянокислого метил-С14-амина аналогичным способом, вымывая сухую реакционную смесь горячим метиловым спиртом.
3. Выход 1-метил-1-нитрозомочевины из 1,5 моля солянокислого метиламина составляет 84—98%. Выделенный продукт следует хранить при температуре ниже 20°; при добавлении капли уксусной кислоты устойчивость повышается. Джонс получил 1-метил-С14-1-нитрозомочевину с ВЫХОДОМ 77% в расчете на цианистый натрий (радиохимический выход 76%).
4. При аналогичном способе получения реагенты берут в следующих пропорциях: 3 г 1-метил-1-нитрозомочевины, 50 мл эфира и 10 мл 10 н. раствора едкого натра.
5. При проведении реакции в больших масштабах рекомендуется отгонять не весь эфир.
6. Выход продукта при проведении реакции с количествами веществ порядка 30 молей составляет 65—68% или до 55%; в расчете на карбонат-С13 бария. Джонс получал диазометан-С14 с выходом 60% в расчете на цианистый натрий. Радиохимический выход 54%. Вещество анализировали в виде метилового-С14 эфира 3, 5-динитро-о-толуиловой кислоты.
7. Эфирный раствор промывают раствором бикарбоната натрия и водой, сушат сульфатом натрия и испаряют. Остаток перекристаллизовывают из петролейного эфира, причем образуется кристаллический бис(метиловый-С13) эфир мезодибромянтарной кислоты (призмы, т. пл. 63°), который окисляют для анализа до двуокиси углерода-С13.
В круглодонную колбу емкостью 500 мл, снабженную капельной воронкой, трубкой для введения азота и обратным холодильником, помещают горячий раствор 75 г едкого кали в 180 мл абсолютного спирта и прибавляют раствор 15 г гидразингидрата в 50 мл абсолютного спирта. Пропуская через прибор слабый ток азота, к смеси медленно по каплям прибавляют раствор 40 г хлороформа в 50 мл абсолютного спирта, причем начинается бурная реакция. Пары диазометана, выходящие через обратный холодильник, либо улавливают в охлажденном эфире, диоксане или в другом растворителе, либо используют тут же для дальнейших превращений. После прибавления хлороформа весь диазометан вытесняют из прибора с помощью азота; выход 2—3 г.
В колбу, снабженную капельной воронкой, трубкой для введения газов, отводной трубкой и механической мешалкой, помещают 6-процентный раствор металлического натрия в гликоле. Пропуская через прибор ток азота, медленно по каплям прибавляют нитрозометилуретан, причем на каждые 10 мл раствора гликолята прибавляют не более 5 мл нитрозосоединения. Спокойное выделение диазометана должно начаться немедленно; в противном случае прерывают прибавление нитрозосоединения, выжидая начала реакции. Выделяющийся диазометан сначала пропускают через небольшую пустую промывальную склянку, охлажденную льдом, и затем либо улавливают в растворителе, либо непосредственно используют для дальнейших реакций.
Внимание! Диазометан токсичен и взрывоопасен. Настоящий синтез следует проводить в хорошо действующем вытяжном шкафу за защитным щитом (см. примечание 1).
Эффективный холодильник (не короче 60 см) снабжают алонжем, к которому припаяна 9-миллиметровая трубка, доходящая почти до дна 5-литровой круглодонной колбы, которая служит приемником при перегонке (примечания 2 и 3). Алонж присоединен к приемнику при помощи пробки с двумя отверстиями, в одно из которых вставляют осушительную трубку, если хотят получить безводный диазометан. Приемник помещают в хорошо перемешанную смесь льда с солью и наливают достаточное количество (около 200 мл) абсолютного эфира, так чтобы конец алонжа был в него погружен.
В 5-литровую колбу наливают 3 л эфира (отвечающего требованиям фармакопеи), 450 мл моноэтилового эфира диэтиленгликоля (примечание 4) и 0,6 л 30%-ного водного раствора едкого натра (примечание 5). Смесь охлаждают до 0° в бане со смесью льда и соли (примечание 6) и сразу прибавляют к ней 180 г (0,5 моля) бис-(N-метил-N-нитрозо)терефталимида (70%-ный раствор в минеральном масле) (примечание 7). Колбу тотчас ставят на электроплитку и присоединяют к ней при помощи изогнутой трубки холодильник. Почти немедленно в приемнике становится заметной желтая окраска диазометана. За 2—2,5 часа отгоняют около 2 л эфира (примечание 8). На этой, стадии отгоняемый эфир становится фактически бесцветным. Во время перегонки конец алонжа должен быть все время немного ниже поверхности дистиллата. Титрованием определяют, что дистиллят содержит 0,76—0,86 моля (76—86% теоретич.) диазометана (примечания 9 и 10). Если прибор был защищен осушительной трубкой, то полученный диазометан пригоден для реакции с хлорангидридом без дополнительного высушивания.
Примечания
1. Диазометан не только ядовит, но и взрывоопасен. Следовательно, необходимо надевать толстые перчатки, очки-консервы и вести работу за предохранительным щитом или за дверцей вытяжного шкафа с безосколочным стеклом, как это рекомендуют при описании метода получения диазометана де Боер и Бекер. Там же указано, что следует избегать шлифов и поверхностей с резкими выступами. Таким образом, все стеклянные трубки должны быть тщательно оплавлены, соединения должны осуществляться при помощи резиновых пробок, причем надо избегать делительных воронок, а также градуированных или поцарапанных колб. Известен случай взрыва диазометана в тот момент, когда кристаллы (острые кромки) внезапно выделялись из пересыщенного раствора. Перемешивание при помощи магнитной мешалки, покрытой тефлоном, следует предпочесть взбалтыванию реакционной смеси вручную, так как известен случай, когда во время такого взбалтывания реакционного сосуда при получении диазометана химику взрывом повредило руку.
Крайне важно, чтобы растворы диазометана не подвергались непосредственному действию солнечного света или не находились поблизости от сильного источника искусственного света, так как предполагается, что свет был причиной некоторых взрывов, происшедших при работе с диазометаном. Особую осторожность следует соблюдать при применении органических растворителей, имеющих более высокую температуру кипения, чем эфир; поскольку упругость паров такого растворителя меньше упругости паров эфира, концентрация диазометана в парах над реакционной смесью будет больше и тем самым увеличивается возможность взрыва.
Наиболее часто диазометан взрывается во время перегонки. Поэтому диазометан не следует перегонять, если только это не оправдывается особой необходимостью. Эфирный раствор диазометана, вполне пригодный для работы во многих случаях, можно получить, как описано Арндтом. Нитрозометилмочевину прибавляют к смеси эфира и 50%-ного водного раствора едкого кали, затем эфирный раствор диазометана декантацией отделяют от водного слоя и сушат гранулированным едким кали (а не над едким кали в палочках, которые имеют острые края). Если требуется перегнанный диазометан, то рекомендуется методика, разработанная де Боер и Бекером, так как в принятых условиях в перегонной колбе всегда имеется лишь небольшое количество диазометана.
Вопрос о токсичности диазометана, а также о его взрывоопасности рассмотрен Гутше.
2. Если желательно определить выход диазометана титрованием, то приемник следует калибровать так, чтобы объем дистиллата можно было измерить без переливания в градуированную посуду.
3. Авторы синтеза применяли прибор, собранный полностью на несмазанных стеклянных шлифах 29/42 (см. примечание 1). Авторы синтеза полагают, что стеклянные шлифы не представляют дополнительной опасности и что их применение способствует более быстрому проведению ряда последовательных опытов. Однако было обнаружено, что после ряда синтезов на шлифах образовывалась пленка из полиметилена, в результате чего нарушалась герметичность прибора. Эту пленку можно удалить, обрабатывая шлифы горячим раствором концентрированной щелочи и сильно протирая их. При проведении авторами примерно сорока опытов произошел один взрыв, который был приписан образованию трещины в алонже во время перегонки. Алонж и осушительная трубка разлетелись на куски, но приемник и содержимое перегонной колбы не пострадали, что указывает на наличие местной детонации, которая не распространилась дальше.
Проверявшие синтез не применяли стеклянной посуды с шлифами. Они применяли новые немаркированные колбы и холодильник, причем прибор был собран с использованием оплавленных стеклянных трубок и резиновых пробок.
4. Продажный 2-(2-этоксиэтокси)этиловый спирт марки «для практических целей» можно использовать без дополнительной очистки. В нескольких случаях авторы встретились с затруднениями во время перегонки, заключавшимися в том, что в колбе образовался очень твердый гель динатриевой соли терефталевой кислоты. В одном случае было выяснено, что эти затруднения были связаны с тем, что был использован 2-(2-этоксиэтокси)этиловый спирт из старой склянки.
Установлено, что именно при таком сравнительно большом объеме дополнительного растворителя получаются наилучшие выходы. Авторы синтеза нашли, что при перемешивании суспензии реагента в эфире и 40%-ном водном растворе едкого натра диазометан выделяется чрезвычайно медленно и его выделение не доходит до конца.
5. Применение более концентрированных растворов едкого кали приводит к несколько пониженным выходам.
6. Внимание! Чрезвычайно важно, чтобы температура содержимого колбы при охлаждении не была выше 0°. Реакция протекает быстро, и при этой температуре выделяется значительное количество диазометана.
7. Применялось продажное масло марки EXR-101. 30%-ное бесцветное минеральное масло служит стабилизатором. Раствор можно хранить при комнатной температуре очень долго. Подробности, касающиеся свойств этого масла, и рекомендуемые меры предосторожности при его применении описаны в соответствующих фирменных проспектах. Масло EXR-101 при долгом стоянии иногда окрашивается в зеленый цвет, но это не оказывает влияния на выход диазометана (частное сообщение Мак-Кузика).
8. Если перегонку вести медленнее, то выход диазометана снижается.
9. Средний выход примерно в 30 опытах был выше 80%; в отдельных опытах выход достигал 95%. Возможно, что применение второго приемника позволило бы уловить дополнительно небольшое количество диазометана.
10. Проверявшие синтез разлагали небольшое количество диазометана, оставшегося в реакционной колбе, путем осторожного прибавления 100 мл уксусной кислоты.
11. Значительными преимуществами настоящего метода являются доступность, умеренная стоимость и высокая стабильность нитрозоамида и пригодность метода для получения диазометана в больших масштабах. Самый процесс прост и протекает быстро; выходы неизменно выше, чем при использовании любого другого метода, испытанного авторами.
Диазометан чрезвычайно ядовит. При получении диазометана и при работе с ним необходимо соблюдать сугубую осторожность.
В круглодонную колбу емкостью 500 мл помещают 60 мл 50%-ного водного раствора едкого кали и 200 мл эфира. Смесь охлаждают до 5°С, после чего при взбалтывании прибавляют 20,6 г (0,2 мол.) нитрозометилмочевины. Колбу присоединяют к обращенному вниз холодильнику, нижний конец которого снабжен алонжем, проходящим через резиновую пробку с двумя отверстиями и погруженным в 40 мл эфира, находящихся в конической колбе на 300 мл, охлаждаемой смесью льда и соли. Отходящие газы проходят еще через одну ловушку с эфиром (40 мл), которая также охлаждается до температуры ниже 0°. Реакционную колбу погружают в водяную баню, нагретую до 50°, и эфир в колбе доводят до кипения, причем время от времени колбу взбалтывают. Отгонку эфира прекращают, как только переходящий дестиллат сделается бесцветным. Обычно это наступает после того, как отогнаны 2/3 эфира. Ни в коем случае не следует отгонять весь эфир. В обоих приемниках с эфиром находится в растворенном состоянии от 5,3 до 5,9 г диазометана (63—70% теоретич.; примечания 1 и 2), который для большинства целей является достаточно сухим. Если требуется сухой (примечание 3) эфирный раствор, то его оставляют стоять 3 часа над чистым гранулированным едким кали (примечание 4). Для получения совершенно сухого раствора его сушат натриевой проволокой.
Примечания
1. Для анализа определенный объем полученного раствора (около 1/20 части) прибавляют при 0° к точной навеске чистой бензойной кислоты (около 1,3 г), растворенной в 50 мл абсолютного эфира. Бензойная кислота должна быть взята в избытке, о чем можно заключить по полному обесцвечиванию раствора диазометана. Не прореагировавшую бензойную кислоту оттитровывают 0,2 н. раствором щелочи.
2. Та же методика может быть применена и для получения в два или три раза большего количества диазометана.
3. Полученный по этому способу раствор диазометана не содержит ни аммиака, ни метилового спирта. В нем содержатся следы метиламина, который образуется также и при получении диазометана из нитрозометилуретана.
Если не требуется чистого безводного раствора, как это часто случается при экспериментах с небольшим количеством материала, можно воспользоваться упрощенной методикой. К 100 мл эфира добавляют 30 мл 40%-ного едкого кали и смесь охлаждают до 5 . Затем при непрерывном охлаждении и взбалтывании в течение 1—2 мин. добавляют маленькими порциями всего 10 г хорошо измельченной нитрозометилмочевины. Темно-желтый эфирный слой легко отделяют декантацией; он содержит 2,8 г диазометана, а также небольшое количество растворенных примесей и воды. Последнюю можно удалить, высушив раствор гранулированным едким кали в течение 3 час. Аналогичным образом можно получить раствор диазометана в бензоле и других не смешивающихся с водой органических растворителях.
4. Не следует применять едкое кали в виде разломанных палочек, так как острые края облегчают разложение диазометана.
Взрывается при нагревании до 100 С, на развитой стеклянной поверхности, под действием щелочных металлов. При комнатной температуре неустойчив. Относительно стабилен в эфирных и диоксановых растворах (концентрированные растворы тоже взрывоопасны). В присутствии порошков меди и хлорида кальция легко разлагается на азот и полиметилен.
Реагирует с ацетиленом с образованием пиразола. Эфиры фумаровой кислоты мгновенно присоединяют диазометан с образованием эфиров пиразолиндикарбоновой кислоты.
При действии диазометана на нитромочевину, в результате метилирования продуктов распада образуются диметилнитрамид и метилизоцианат.
Интересна реакция диазометана с комплексным соединением диэтилового эфира и хлорида цинка: (C2H5)2O·ZnCl2 + 2CH2N2 → CH3CH2CH2CH3 + N2 + ClCH2CHCl + ZnO. При действии трифенилметилнатрия на диазометан, происходит замещение водорода в диазометане на натрий; осторожным подкислением продукта этой реакции получают наряду с исходным диазометаном, изодиазометан CHN=NH.