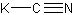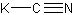Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
калия цианид
Синонимы и иностранные названия:
potassium cyanide (англ.)
калий цианистый (рус.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
цианид калияТип вещества:
неорганическое
Внешний вид:
бесцветн. кубические кристаллыБрутто-формула (по системе Хилла для органических веществ):
CKNФормула в виде текста:
KCNМолекулярная масса (в а.е.м.): 65,12
Температура плавления (в °C):
634,5Растворимость (в г/100 г растворителя или характеристика):
аммиак жидкий: 4,56 (-33,9°C) [Лит.]
вода: 63 (0°C) [Лит.]
вода: 71,6 (25°C) [Лит.]
вода: 81 (50°C) [Лит.]
вода: 122 (100°C) [Лит.]
гидроксиламин: 41 (17,5°C) [Лит.]
глицерин: 32 (15,5°C) [Лит.]
диметиламин: мало растворим [Лит.]
диметилсульфоксид: не растворим [Лит.]
диметилформамид: 0,22 (25°C) [Лит.]
диоксид серы: 0,017 (0°C) [Лит.]
метанол: 4,9 (19,5°C) [Лит.]
оксид-трихлорид фосфора(V): 0,044 (20°C) [Лит.]
пиридин: мало растворим [Лит.]
уксусная кислота: легко растворим [Лит.]
формамид: 12,9 (25°C) [Лит.]
этанол абсолютный: 0,87 (19,5°C) [Лит.]
этилацетат: не растворим [Лит.]
этиленгликоль: растворим с сольволизом [Лит.]
Фазовая и многокомпонентная растворимость (в масс%):
вода 79,72%, калия цианид 6,75%, серебра цианид 13,53%, 25 °C, отделяющаяся фаза: AgCN [Лит.]
вода 73,34%, калия цианид 8,93%, серебра цианид 17,73%, 25 °C, отделяющаяся фаза: KAg2(CN)3 * H2O [Лит.]
вода 75,33%, калия цианид 8,56%, серебра цианид 16,11%, 25 °C, отделяющаяся фаза: KAg(CN)2 [Лит.]
вода 58,2%, калия цианид 20,14%, серебра цианид 21,66%, 25 °C, отделяющаяся фаза: KAg(CN)2 [Лит.]
вода 45,2%, калия цианид 28,43%, серебра цианид 26,37%, 25 °C, отделяющаяся фаза: KAg(CN)2 [Лит.]
вода 39,63%, калия цианид 35,19%, серебра цианид 25,18%, 25 °C, отделяющаяся фаза: K3Ag(CN)4 * H2O [Лит.]
вода 48,83%, калия цианид 40,24%, серебра цианид 10,93%, 25 °C, отделяющаяся фаза: KCN [Лит.]
вода 91,51%, золота(I) цианид 6,12%, калия цианид 2,37%, 25 °C, отделяющаяся фаза: AuCN [Лит.]
вода 90,13%, золота(I) цианид 2,6%, калия цианид 7,27%, 25 °C, отделяющаяся фаза: AuCN [Лит.]
вода 79,75%, золота(I) цианид 15,47%, калия цианид 4,78%, 25 °C, отделяющаяся фаза: KAu(CN)2 + AuCN [Лит.]
вода 83,79%, золота(I) цианид 11,02%, калия цианид 5,19%, 25 °C, отделяющаяся фаза: KAu(CN)2 [Лит.]
вода 84,64%, золота(I) цианид 8,34%, калия цианид 7,02%, 25 °C, отделяющаяся фаза: KAu(CN)2 [Лит.]
вода 87,37%, золота(I) цианид 2,97%, калия цианид 9,66%, 25 °C, отделяющаяся фаза: KAu(CN)2 [Лит.]
вода 74,94%, золота(I) цианид 1,27%, калия цианид 23,79%, 25 °C, отделяющаяся фаза: KAu(CN)2 [Лит.]
вода 60,67%, золота(I) цианид 0,35%, калия цианид 38,98%, 25 °C, отделяющаяся фаза: KAu(CN)2 [Лит.]
вода 57,85%, золота(I) цианид 0,17%, калия цианид 41,98%, 25 °C, отделяющаяся фаза: KCN + KAu(CN)2 [Лит.]
Плотность:
1,56 (20°C, г/см3, состояние вещества - кристаллы)
Вкус, запах, гигроскопичность:
гигроскопичен
Некоторые числовые свойства вещества:
Смертельная доза при приеме внутрь (человек, г): 0,12
Реакции вещества:
- Выше 634 С окисляется кислородом воздуха или оксидом свинца(II) до цианата калия. [Лит.]
KCN + PbO → KOCN + Pb
- В водном растворе постепенно гидролизуется с выделением синильной кислоты и гидроксида калия. [Лит.]
KCN + H2O → HCN + KOH
- При кипячении водных растворов разлагается до формиата калия и аммиака. [Лит.]
KCN + 2H2O → HCOOK + NH3
- Во влажном воздухе взаимодействует с углекислым газом с образованием карбоната калия и синильной кислоты. [Лит.]
2KCN + CO2 + H2O → 2HCN + K2CO3
- Реагирует с водным раствором гидросульфита калия с образованием умеренно растворимого аминометандисульфоната калия. [Лит.]
KCN + 3KHSO3 → H2NCH(SO3K)2 + K2SO3
- С переходными металлами образует комплексы, например, с солями железа(II) образуется гексацианоферрат (II) калия. [Лит.]
- Бромциан получают реакцией водного раствора цианида калия с бромом. Выход 90%. [Лит.1
 , Лит.2
, Лит.2 ]
]
KCN + Br2 → BrCN + KBr
- Иодциан получают реакцией водного раствора цианида калия с иодом. Выход 80%. [Лит.1
 ]
]
KCN + I2 → ICN + KI
- Селеноцианат калия может быть получен сплавлением цианида калия с селеном. Выход 75%. [Лит.1
 ]
]
KCN + Se → KSeCN
- Моногидрат тетрацианоникелата(II) калия можно получить реакцией цианида никеля(II) с водным раствором цианида калия. Выход 97%. [Лит.1
 ]
]
Ni(CN)2 + 2KCN + H2O → K2[Ni(CN)4] * H2O
- Цианид никеля(II) получают реакцией гексагидрата сульфата никеля(II) с водным раствором цианида калия. Выход 98%. [Лит.1
 ]
]
NiSO4 * 6H2O + 2KCN → Ni(CN)2 + K2SO4 + 6H2O
- Тригидрат тетрацианопалладата(II) калия получают реакцией хлорида палладия(II) с водным раствором цианида калия. Выход 70%. [Лит.1
 ]
]
PdCl2 + 4KCN + 3H2O → K2[Pd(CN)4] * 3H2O + 2KCl
- Дицианоаурат(I) калия можно получить растворяя порошкообразное золото в растворе цианида калия в присутствии воздуха. [Лит.1]
4Au + 8KCN + O2 + 2H2O → 4K[Au(CN)2] + 4KOH
- Дициан получают реакцией водного раствора пентагидрата сульфата меди(II) с водным раствором цианида калия. Образующийся желтый цианид меди(II) немедленно разлагается до дициана и цианида меди(I). Выделяющийся газ содержит до 20% углекислого газа. [Лит.1, Лит.2
 , Лит.3, Лит.4
, Лит.3, Лит.4 ]
]
2CuSO4 * 5H2O + 4KCN → (CN)2 + 2CuCN + 2K2SO4 + 5H2O
- Сурьму высокой чистоты можно получить сплавлением оксида сурьмы(III) с цианидом калия. [Лит.1
 ]
]
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-112,5 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-103,9 (т)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
137,03 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
65,06 (т)Энтальпия плавления ΔHпл (кДж/моль):
14,6Летальная доза (ЛД50, в мг/кг):
1,7 (человек, перорально)
Аналитические реакции вещества:
- реагент: сульфат железа(II) и хлорид железа(III) в растворе; результат реакции: син. окрашивание; чувствительность реакции: 40 мкг цианида в 10 мл
- реагент: полисульфид аммония в растворе упаривают досуха с пробой и добавляют раствор хлорида железа(III); результат реакции: красн. окрашивание
- реагент: сульфид меди(II) на фильтровальной бумаге; результат реакции: обесцвечивание; чувствительность реакции: 0,05 мг/мл
- реагент: нитрат серебра, водный раствор; результат реакции: бел. осадок; чувствительность реакции: 4 мкг цианида в 10 мл
Применение вещества:
- для синтеза нитрилов [Лит.]
- для синтеза цианата калия [Лит.]
- компонент электролитов для гальванического золочения [Лит.]
- компонент электролитов для гальванического серебрения [Лит.]
- компонент электролитов для очистки платины от серебра [Лит.]
- реагент для извлечения золота из руд [Лит.]
- реагент для извлечения серебра из руд [Лит.]
- реактив в комплексонометрическом анализе для определения никеля [Лит.]
- реактив в комплексонометрическом анализе для определения ртути [Лит.]
- реактив в комплексонометрическом анализе для определения серебра [Лит.]
Источники информации:
- Armarego W. L. F. Purification of Laboratory Chemicals. - 7ed. - 2013. - С. 600
- Seidell A. Solubilities of inorganic and organic substances. - 2ed. - New York: D. Van Nostrand Company, 1919. - С. 531
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.3. - Л.: Химия, 1976. - С. 265-267
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 70
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 694
- Химическая энциклопедия. - Т. 2. - М.: Советская энциклопедия, 1990. - С. 291
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 235
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер