Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
железа пентакарбонил
Синонимы и иностранные названия:
iron pentacarbonyl (англ.)
Вещество входит в группы:
жидкие соединения металлов
Название вещества с нормальным (не справочным) порядком слов русского языка:
пентакарбонил железа Тип вещества:
неорганическое
Внешний вид:
светло-желт. жидкостьКристаллические модификации, структура молекулы, цвет растворов и паров:
Кристаллы вблизи температуры плавления светло-желтые моноклинные. При охлаждении до -196 С кристаллы обесцвечиваются.
Брутто-формула (по системе Хилла для органических веществ):
C5FeO5Формула в виде текста:
Fe(CO)5Молекулярная масса (в а.е.м.): 195,9
Температура плавления (в °C):
-21Температура кипения (в °C):
105Температура разложения (в °C):
130Температура вспышки (в °C):
-15 [Лит.]
Растворимость (в г/100 г растворителя или характеристика):
амиловый спирт: смешивается [Лит.]
аммиак жидкий: практически не растворим [Лит.]
ацетальдегид: ограниченно растворим [Лит.]
ацетон: растворим [Лит.]
бензальдегид: смешивается [Лит.]
бензин: растворим [Лит.]
бензол: растворим [Лит.]
бромбензол: смешивается [Лит.]
вода: не растворим [Лит.]
диэтиловый эфир: растворим [Лит.]
масляная кислота: ограниченно растворим [Лит.]
петролейный эфир: легко растворим [Лит.]
сероуглерод: смешивается [Лит.]
тетралин: смешивается [Лит.]
тетрахлорметан: смешивается [Лит.]
уксусная кислота: смешивается [Лит.]
формамид: очень мало растворим [Лит.]
хлороформ: очень мало растворим [Лит.]
этанол: мало растворим [Лит.]
этилацетат: смешивается [Лит.]
Плотность:
1,53 (-20°C, г/см3, состояние вещества - жидкость)
1,493 (0°C, г/см3, состояние вещества - жидкость)
1,474 (13,4°C, г/см3, состояние вещества - жидкость)
1,47 (15,5°C, г/см3, состояние вещества - жидкость)
1,468 (16,5°C, г/см3, состояние вещества - жидкость)
1,462 (19°C, г/см3, состояние вещества - жидкость)
1,453 (20°C, г/см3, состояние вещества - жидкость)
1,456 (21,1°C, г/см3, состояние вещества - жидкость)
1,46 (22°C, г/см3, состояние вещества - жидкость)
1,421 (40°C, г/см3, состояние вещества - жидкость)
1,382 (60°C, г/см3, состояние вещества - жидкость)
Энергии, длины и углы связей молекул вещества:
Длина связи (пм): 115 (C-O)
Длина связи (пм): 184 (Fe-C)
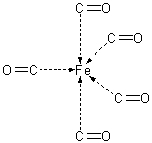
Описание строения молекул и кристаллов вещества:
Молекула имеет структуру тригональной бипирамиды.
Некоторые числовые свойства вещества:
Год открытия: 1891 (Бертело во Франции, Монд, Квинк и Лангер в Англии)
Летальная концентрация в воздухе для 50% животных (ЛК50, мг/л): 2,19 (белые мыши, экспозиция 30 мин)
Летальная концентрация в воздухе для 50% животных (ЛК50, мг/л): 0,91 (белые крысы, экспозиция 30 мин)
Способы получения:
- Пентакарбонил железа можно получить реакцией тонкоизмельченного железа с угарным газом при 200 С и давлении 300 атм. При этом за 2 часа образуется 14,30 мл пентакарбонила железа. При атмосферном давлении реакция идет с ничтожным выходом. [Лит.1]
Fe + 5CO → Fe(CO)5
- Пентакарбонил железа можно получить при реакции дииодида тетракарбонилжелеза с мельчайшим порошком меди при небольшом нагревании. Выход при давлении угарного газа 10 ат почти количественный, при атмосферном давлении - 30%. [Лит.1
 ]
]
5Fe(CO)4I2 + 10Cu → 10CuI + 4Fe(CO)5 + Fe
Реакции вещества:
- Реагирует с газообразным иодоводородом с образованием иодида железа(II), угарного газа и водорода. [Лит.]
Fe(CO)5 + 2HI → FeI2 + 5CO + H2
- Реагирует с концентрированной соляной кислотой с образованием хлорида железа(II), угарного газа и водорода. [Лит.]
Fe(CO)5 + 2HCl → FeCl2 + 5CO + H2
- В жидком аммиаке реагирует с натрием с образованием тетракарбонилферрата натрия. [Лит.]
Fe(CO)5 + 2Na → Na2[Fe(CO)4] + CO
- Под действием света отщепляет угарный газ с образованием нонакарбонила дижелеза. [Лит.]
2Fe(CO)5 → Fe2(CO)9 + CO
- Окисляется водным раствором перманганата калия до оксида железа(III). [Лит.]
- Реагирует с хлоридом меди(II) в ацетоне с образованием хлоридамеди(I), хлорида железа(II) и угарного газа. [Лит.]
- Реагирует с хлоридом вольфрама(VI) в эфире при 90 С с образованием гексакарбонила вольфрама, хлорида железа(II) и угарного газа. [Лит.]
- Реагирует с хлороводородом и бромоводородом в пиридине с образованием галогенидов железа(II), угарного газа и водорода. [Лит.]
- Реагирует с бутадиеном с образованием бутадиентрикарбонила железа и угарного газа. [Лит.]
- При 156 С реагирует с амидом натрия с образованием цианамида мононатрия, водорода, гидроксида натрия и железа. [Лит.]
- Реагирует с хлоридом железа(III) в ацетоне с образованием хлорида железа(II) и угарного газа. [Лит.]
- Энергично реагирует с сульфурилхлоридом с образованием хлорида железа(II), диоксида серы и угарного газа. [Лит.]
- Разрушается разбавленной азотной кислотой. [Лит.]
- Реагирует с тетрахлорметаном. [Лит.]
- При нагревании разлагается на карбонильное железо и угарный газ. [Лит.]
- Тетракарбонилферрат(II) диводорода может быть получен длительным встряхиванием пентакарбонила железа с водным раствором гидроксида натрия или гидроксида калия в атмосфере азота с последующим разложением образовавшейся соли серной или соляной кислотой. [Лит.1
 , Лит.2
, Лит.2 ]
]
Fe(CO)5 + 3NaOH → NaH[Fe(CO)4] + Na2CO3 + H2O
2NaH[Fe(CO)4] + H2SO4 → 2H2[Fe(CO)4] + Na2SO4
- Пентакарбонил железа энергично реагирует с концентрированной серной кислотой с образованием сульфата железа(II), угарного газа и водорода. [Лит.1]
Fe(CO)5 + H2SO4 → FeSO4 + 5CO + H2
- Пентакарбонил железа реагирует с раствором сульфата ртути(II) в 10% серной кислоте с образованием темно-желтого осадка тетракарбонилферрата ртути(II). [Лит.1
 ]
]
Fe(CO)5 + HgSO4 + H2O → HgFe(CO)4 + CO2 + H2SO4
- Пентакарбонил железа легко окисляется и хорошо горит с образованием ярко-рыжего оксида железа(III). Эта реакция лежит в основе промышленного получения магнитной окиси железа для ферритов. [Лит.1]
4Fe(CO)5 + 13O2 → 2Fe2O3 + 20CO2
Реакции, в которых вещество не участвует:
- Не реагирует с сероводородом. [Лит.]
- Не реагирует с сероуглеродом при комнатной температуре. [Лит.]
- Пары пентакарбонила железа не реагируют с алюминием и цинком. [Лит.]
Показатель преломления (для D-линии натрия):
1,523 (14°C)
Давление паров (в мм рт.ст.):
7,5 (0°C)
10 (4,7°C)
28 (18°C)
75 (44°C)
100 (50,3°C)
Диэлектрическая проницаемость:
2,6 (20°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-764 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-695,2 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
338 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
240,6 (ж)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-723,8 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
445 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
168 (г)Некоторые нечисловые свойства вещества:
диамагнитное вещество
Летальная доза (ЛД50, в мг/кг):
1,75 (кролики, перорально)
1,75 (кролики, внутривенно)
Симптомы острого отравления:
Сильно ядовит при вдыхании, введении внутрь или всасывании через неповрежденную кожу. Вызывает острый отек легких независимо от пути введения. Предполагают, что выделение происходит через легкие. В условиях производства отравления протекали сходно с картиной интоксикации угарным газом.
Дополнительная информация::
Потенциал ионизации 8,53 в.
Реагирует с тетрахлорметаном с образованием хлорида железа (II), гексахлорэтана и угарного газа. В эфирном растворе реагирует с серной кислотой с образованием сульфата железа (II), угарного газа и водорода. При действии щелочей в вакууме образуется тетракарбонилдигидрид железа. С жидким аммиаком при 20 С (под давлением) дает мочевину и тетракарбонилферрат аммония. Гидролизуется водой.
Применение вещества:
- антидетонатор для автобензинов [Лит.]
- для получения высокочистого оксида железа(III) (получаемый оксид железа(III) используется для магнитной записи, для изготовления ферритов) [Лит.]
- для получения карбонильного железа [Лит.]
Источники информации:
- Bell C.F. Syntheses and Physical Studies of Inorganic Compounds. - Pergamon Press, 1972. - С. 169-175
- CRC Handbook of Chemistry and Physics. - 95ed. - CRC Press, 2014. - С. 3-326, 4-68
- Lewis R.J. Sax's Dangerous Properties of Industrial Materials. - 12ed., Vol. 1-5. - Wiley, 2012. - С. 2595-2596
- The Merck Index 11th ed., Merck & Company, 1989. - С. 806
- The Merck Index. - 15th ed. - Royal Society of Chemistry, 2013. - С. 948-949
- Белозерский Н.А. Карбонилы металлов. - М.: ГНТИЛЧЦМ, 1958. - С. 46-134
- Волков В.Л., Сыркин В.Г., Толмасский И.С. Карбонильное железо. - М.: Металлургия, 1969. - С. 27-34
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.3. - Л.: Химия, 1976. - С. 529
- Гринвуд Н., Эрншо А. Химия элементов. - Т.2. - М.: БИНОМ. Лаборатория знаний, 2008. - С. 432
- Некрасов Б.В. Основы общей химии. - Т.2. - М.: Химия, 1973. - С. 345-346
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 63
- Химическая энциклопедия. - Т. 2. - М.: Советская энциклопедия, 1990. - С. 130
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер