Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
хлора(V) фторид
Синонимы и иностранные названия:
chlorine pentafluoride (англ.)
хлора пентафторид (рус.)
хлорпентафторид (рус.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
фторид хлора(V) Тип вещества:
неорганическое
Внешний вид:
бесцветн. газБрутто-формула (по системе Хилла для органических веществ):
ClF5Формула в виде текста:
ClF5Молекулярная масса (в а.е.м.): 130,44
Температура плавления (в °C):
-93Температура кипения (в °C):
-13Температура разложения (в °C):
165Продукты термического разложения:
хлора(III) фторид; фтор; Плотность:
1,93 (-20°C, г/см3, состояние вещества - жидкость)
Метод получения 1:
Источник информации: Journal of Fluorine Chemistry. - 1985. - Vol. 29, No. 4 стр. 461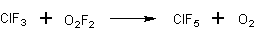
Пассивированный реактор из монель-металла был присоединени к вакуумной линии и оснащен балластом объемом 190 мл вместе с датчиком давления. Трифторид хлора (1,6 ммоль) конденсируют в реакторе при -196 С. Сохраняя в реакторе температуру -196 С в данамическом вакууме в реактор переносят 1,5 мл диоксидифторида (примерно 3 г или 40 ммоль). После откачки фтора и кислорода, образовавшихся при частичном разложении диоксидифторида, реактор герметизировали и жидкий азот заменили на баню со смесью сухого льда и жидкого азота. В течение нескольких часов температура поднималась от -196 С до -78 С. Реактор поддерживали при -78 С в течение 16 часов, при этом давление поднималось примерно до 200 мм рт.ст. за счет разложения диоксидифторида. После удаления кислорода и фтора при -196 С получено 4,1 ммоля сырого продукта, который по данным колебательной спектроскопии состоял из пентафторида хлора, тетрафторида кремния, фтороводорода и фторированных углеводородов, но не содержат трифторида хлора. Дистилляция дала 1,6 ммоля чистого пентафторида хлора (в ловушке с температурой -137 С), загрязненного только следами фторуглеводородов. Выход составил практически 100%.
Способы получения:
- Реакция трифторида хлора с фтором при давлении 35 бар (при комнатной температуре) и нагреве до 200 С в присутствии фторида никеля(II). [Лит.]
- Фотохимический синтез из фтора и трифторида хлора позволяет получить 3 г/час вещества. (выход 100%) [Лит.]
- Реакцией трифторида хлора с диоксидифторидом при -78 С. (выход 100%) [Лит.]
Реакции вещества:
- При 195 К с пентафторидом мышьяка дает аддукт (1/1), который полностью диссоциирует в газовой фазе. [Лит.]
- Бурно реагирует с водой и водяным паром. При избытке пентафторида хлора образуется хлорилфторид и фтороводород. [Лит.]
- При избытке пентафторида хлора реагирует с азотной кислотой с образованием хлорилфторида, фторида нитрония и фтороводорода. [Лит.]
- Энергично реагирует с активированным углем при комнатной температуре с образованием хлора, тетрафторметана, трифторхлорметана и гексафторэтана. [Лит.]
- Медленно реагирует с гексафторидом платины при комнатной температуре при облучении дневным светом с образованием смеси гексафторплатинатов(V) тетрафторхлора(V) и гексафторхлора(VII). [Лит.]
- Реагирует с нитратами щелочных металлов с образованием диоксида-фторида хлора(V), фторида металла и фторида нитрония. [Лит.]
- Гексафтороарсенат(V) гексафторхлора(VII) получен реакцией пентафторида хлора с дифторидом криптона и пентафторидом мышьяка в условиях циклического нагрева от -196 С до +20 С. Выход 11,15%. [Лит.1
 ]
]
KrF2 + ClF5 + AsF5 → (ClF6)[AsF6] + Kr
- Гексафтороарсенат(V) гексафторхлора(VII) может быть получен реакцией пентафторида хлора с гексафтороникелатом(IV) цезия и пентафторидом мышьяка в жидком фтороводороде. Выход 40%. [Лит.1
 ]
]
Cs2NiF6 + 5AsF5 + ClF5 → (ClF6)[AsF6] + Ni(AsF6)2 + 2CsAsF6
- Пентафторид хлора реагирует с фторидом тетраметиламмония в ацетонитриле с образованием белого, твердого, взрывчатого гексафторохлората(V) тетраметиламмония. [Лит.1
 ]
]
(CH3)4NF + ClF5 → (CH3)4N[ClF6]
- Гексафтороарсенат(V) фтордиазония окисляется пентафторидом хлора при 70 С за 3 дня до небольшого количества гексафторарсената трифтордиазина. [Лит.1]
Реакции, в которых вещество не участвует:
- Не реагирует с трифторидом бора. [Лит.]
- При комнатной температуре не реагирует в течение нескольких дней с оксидом-тетрафторидом молибдена. [Лит.]
- Не дает комплексов с фторидом цезия и нитрозилфторидом. [Лит.]
- Не реагирует с дифторидом ксенона. [Лит.]
- Гексафтороарсенат(V) фтордиазония не окисляет при 25 °С во фтороводороде пентафторид хлора, пентафторид брома, пентафторид иода, тетрафторид ксенона, кислород, трифторид азота. [Лит.1]
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-238 (г)Дополнительная информация::
Водой разлагается. С SbF5, AsF5 и PtF5 образует соли ClF4+; с BF3 - солей не дает. Энергичный фторирующий агент, но корродирует металлы слабее, чем ClF3. Реагирует с щелочами с образованием фторидов и хлоратов, диоксидом кремния - с образованием терафторида кремния, хлора и кислорода.
Источники информации:
- Исикава Н., Кобаяси Ё. Фтор: химия и применение. - М.: Мир, 1982. - С. 75
- Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ. - М.: Химия, 2000. - С. 264
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 256
- Росоловский В.Я. Тонкий неорганический синтез. - М.: Знание, 1979 (журнал Знание №2 1979). - С. 46
- Термодинамические свойства индивидуальных веществ. - Т.1, Кн.2. - М.: Наука, 1978. - С. 108
- Химмотология ракетных и реактивных топлив. - Под ред. Браткова А.А. - М.: Химия, 1987. - С. 77-78
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер