Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
брома(V) фторид
Синонимы и иностранные названия:
bromine pentafluoride (англ.)
брома пентафторид (рус.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
фторид брома(V)Тип вещества:
неорганическое
Внешний вид:
бесцветн. жидкостьКристаллические модификации, структура молекулы, цвет растворов и паров:
Молекула имеет форму тетрагональной пирамиды.
Брутто-формула (по системе Хилла для органических веществ):
BrF5Формула в виде текста:
BrF5Молекулярная масса (в а.е.м.): 174,92
CAS №: 7789-30-2
Температура плавления (в °C):
-61,3Температура кипения (в °C):
40,8Температура разложения (в °C):
550Растворимость (в г/100 г растворителя или характеристика):
ацетонитрил: растворим [Лит.]
вода: реагирует [Лит.]
трифторид брома: смешивается [Лит.]
фтороводород: смешивается [Лит.]
фтортрихлорметан: растворим [Лит.]
Плотность:
2,47 (25°C, г/см3, состояние вещества - жидкость)
Метод получения 1:
Источник информации: Руководство по неорганическому синтезу. - Т.1, под ред. Брауэра Г. - М.: Мир, 1985 стр. 192-193Br2 + 5F2 → 2BrF5
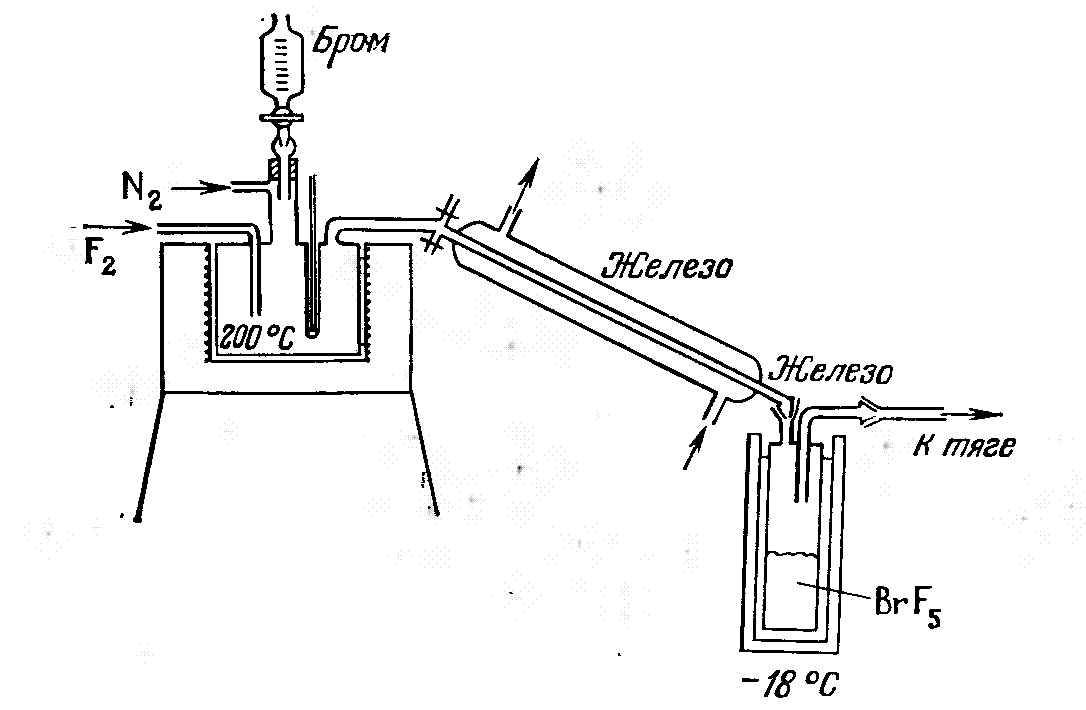
В тигельную печь, позволяющую вести нагревание до 200 С, помещают реакционный сосуд из железа. Реакционный сосуд снабжен трубкой для подвода фтора, газоотводной трубкой для отведения пентафторида брома, штуцером для термометра и широкой трубкой (по центру), в которую вставлена капельная воронка и которая имеет сбоку отводную трубку для подачи азота (поток азота предотвращает соприкосновение фтора с капельной воронкой). Газы, вступающие в реакцию, конденсируются в железном холодильнике. Сжиженный пентафторид брома собирается в железной ловушке, которую охлаждают смесью льда и поваренной соли.
Как только прибор заполняется фтором, начинают прибавлять по каплям бром. При токовой нагрузке электролизера для получения фтора 150 А скорость подачи брома 1 капля/с. Следят за тем, чтобы фтор всегда был в избытке. Сырой продукт содержит 95% пентафторида и 5% трифторида брома. По окончании фторирования продукт перегоняют в приборе, изготовленном из железа, в потоке фтора. Холодильник и приемник (при перегонке) охлаждают смесью льда и поваренной соли (температура около -18 С).
Выход 87% в расчете на бром. Пентафторид брома - бесцветная, сильно дымящая на воздухе жидкость. До 460 С не разлагается. Т. пл. -61,3 С, т. кип. +40,5 С, d (ж) = 2,57 (0 С). Очень реакционноспособен, реагирует почти со всеми элементами с воспламенением, с водой реакция часто сопровождается взрывом. В отсутствии влаги при обычной температуре медленно разъедает стекло; практически не действует на кварц.
Способы получения:
- Реакцией брома с фтором. [Лит.]
- Реакцией трифторида брома с фтором. [Лит.]
- Фтор энергично реагирует с бромом с образованием смеси трифторида брома и пентафторида брома. Соотношение продуктов зависит от количества фтора. [Лит.1]
Реакции вещества:
- Реагирует с фторидом цезия с образованием гексафторбромата(V) цезия. [Лит.]
- Реагирует с нитратом натрия с образованием оксотетрафторбромата(V) натрия и фторида нитрония. [Лит.]
- Реагирует с нитратом лития с образованием оксида-трибромида брома(V). [Лит.]
- Гексафтороарсенат(V) гексафторброма(VII) может быть получен реакцией пентафторида брома с гексафтороникелатом(IV) цезия и пентафторидом мышьяка в жидком фтороводороде. Выход 32%. [Лит.1
 ]
]
Cs2NiF6 + 5AsF5 + BrF5 → (BrF6)[AsF6] + Ni(AsF6)2 + 2CsAsF6
- Гексафтораурат(V) фторкриптона(II) окисляет пентафторид брома до гексафтораурата(V) гексафторброма(VII). [Лит.1]
Реакции, в которых вещество не участвует:
- Нагревание пентафторида брома со фтором и пентафторидом мышьяка при 200-250 С и давлении 125-200 атм в реакторе из монель-металла в течение 3 дней дало только исходные вещества. [Лит.1]
- Гексафтороарсенат(V) фтордиазония не окисляет при 25 °С во фтороводороде пентафторид хлора, пентафторид брома, пентафторид иода, тетрафторид ксенона, кислород, трифторид азота. [Лит.1]
Показатель преломления (для D-линии натрия):
1,3529 (25°C)
Давление паров (в мм рт.ст.):
10 (-40°C)
100 (-5°C)
Диэлектрическая проницаемость:
8,33 (-11,7°C)
8,21 (0,2°C)
8,02 (14,5°C)
7,91 (24,5°C)
Дипольный момент молекулы (в дебаях):
1,5 (20°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-458,6 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-351,8 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
225,1 (ж)Энтальпия плавления ΔHпл (кДж/моль):
7,36Энтальпия кипения ΔHкип (кДж/моль):
30,6Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-428,9 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-350,6 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
320,2 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
99,6 (г)История:
Впервые получен в 1931 г.
Дополнительная информация::
Дымит на воздухе. Реагирует с водой со взрывом, но реакция идет спокойнее, когда смесь разбавляют ацетонитрилом, при этом получаются бромноватая кислота и фтороводород.
Источники информации:
- Bretherick's Handbook of Reactive Chemical Hazards. - 6 ed., Vol. 1. - Butterworth-Heinemann, 1999. - С. 97-98
- Ахадов Я.Ю. Диэлектрические параметры чистых жидкостей. - М.: Издательство МАИ, 1999. - С. 160
- Галкин Н.П., Майоров А.А., Верятин У.Д., Судариков Б.Н., Николаев Н.С., Шишков Ю.Д., Крутиков А.Б. Химия и технология фтористых соединений урана. - М.: ГИЛОАНТ, 1961. - С. 337-341
- Гринвуд Н., Эрншо А. Химия элементов. - Т.2. - М.: БИНОМ. Лаборатория знаний, 2008. - С. 179-181
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 278
- Никитин И.В. Фториды и оксифториды галогенов. - М.: Наука, 1989. - С. 44-51
- Николаев Н.С., Суховерхов В.Ф., Шишков В.Д., Аленчикова И.Ф. Химия галоидных соединений фтора. - М.: Наука, 1968. - С. 208-245
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 57
- Рысс И.Г. Химия фтора и его неорганических соединений. - М., 1956. - С. 135-136
- Фиалков Я.А. Межгалоидные соединения. - Киев: Издательство АН Украинской ССР, 1958. - С. 75-81
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер

