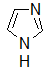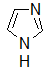Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
имидазол
Синонимы и иностранные названия:
1,3-диазол (рус.)
glyoxaline (англ.)
imidazole (англ.)
глиоксалин (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. призматические кристаллы (растворитель перекристаллизации - бензол)Брутто-формула (по системе Хилла для органических веществ):
C3H4N2Молекулярная масса (в а.е.м.): 68,07
CAS №: 288-32-4
Температура плавления (в °C):
90Температура кипения (в °C):
256Растворимость (в г/100 г растворителя или характеристика):
ацетон: растворим [Лит.]
бензол: мало растворим [Лит.]
вода: 206 (19°C) [Лит.]
диэтиловый эфир: растворим [Лит.]
петролейный эфир: мало растворим [Лит.]
пиридин: растворим [Лит.]
хлороформ: растворим [Лит.]
этанол: легко растворим [Лит.]
Плотность:
1,0303 (101°C, г/см3, состояние вещества - жидкость)
Метод получения 1:
Источник информации: Синтезы органических препаратов. - Ч. 3. - М., 1952 стр. 256
90 г имидазол-4,5-дикарбоновой кислоты делят на две части. Каждую часть тщательно смешивают с 0,5 г медно-хромового катализатора или окиси меди в порошке (выход несколько меньше) и полученную смесь переносят в перегонную колбу емкостью 250 мл. Перегонную колбу осторожно нагревают голым пламенем горелки. После небольшого головного погона (95-100°С) температура резко повышается до 260°С и имидазол перегоняется при 200-270°С. С целью очистки вещество растворяют в 60-70 г бензола, раствор кипятят в течение нескольких минут с 2-Зг угля для обесцвечивания, смесь фильтруют через предварительно нагретую воронку Бюхнера и охлаждают фильтрат до 10 С в течение 2 час.
Выход составляет 13-14,5 г (68-76% теоретич.). Препарат бесцветен; т. пл. 88-90°С. Бензольный экстракт после перекристаллизации содержит еще около 0,5 г имидазола.
Способы получения:
- Реакцией этиленкеталя бромацетальдегида с формамидом в течение 6 часов при 175 С. (выход 50%) [Лит.]
Реакции вещества:
- Метилируется гидроксидом триметилсульфония при 70 С в течение 20 минут с образованием 1-метилимидазола. (выход 100%) [Лит.]
- Реагирует с небольшим избытком уксусного ангидрида с образованием N-ацетилимидазола. (выход 100%) [Лит.]
- Имидазол легко нитруется смесью азотной и серной кислот с образованием 4(5)-нитроимидазола. Выход 63%. [Лит.1, Лит.2
 ]
] - При действии перекиси водорода на имидазол образуется оксамид. [Лит.1]
Реакции, в которых вещество не участвует:
- Имидазол не восстанавливается амальгамой натрия, цинком с соляной кислотой, красным фосфором и иодистоводородной кислотой. [Лит.1]
Показатель преломления (для D-линии натрия):
1,4801 (101°C)
Давление паров (в мм рт.ст.):
12 (138,2°C)
Показатели диссоциации:
pKBH+ (1) = 7,1 (25°C, вода)
pKa (1) = 14,2 (25°C, вода)
Дипольный момент молекулы (в дебаях):
6,21 (20°C)
3,98Стандартная энтальпия образования ΔH (298 К, кДж/моль):
49,8 (т)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
132,9 (г)Летальная доза (ЛД50, в мг/кг):
220 (крысы, перорально)
626 (крысы, подкожно)
880 (мыши, перорально)
300 (мыши, внутрибрюшинно)
Дополнительная информация::
Обладает ароматическими свойствами. По атому N-1 легко образуются N-алкил, N-ацилпроизводные. Атом N-3 - нуклеофильный центр, по которому протекают протонирование, кватернизация и комплексообразование. Электрофильное замещение происходит в положения 4 и 5, нуклеофильное - в положение 2. Устойчив к действию большинства окислителей и восстановителей: не окисляется перманганатом, азотной кислотой, хромовой кислотой, но расщепляется пероксидами.
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-23
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 8-106
- Stahl P.H., Wermuth C.G. Handbook of Pharmaceutical Salts: Properties, Selection, and Use. - Wiley-VCH, 2002. - С. 318-319
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 150
- Справочник химика. - Т. 2. - Л.-М.: Химия, 1964. - С. 698-699
- Химическая энциклопедия. - Т. 2. - М.: Советская энциклопедия, 1990. - С. 210
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 217
- Химия: справочное руководство. - Под ред. Гаврюченкова Ф.Г., Курочкиной М.И. и др. - Л.: Химия, 1975. - С. 368-370
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер