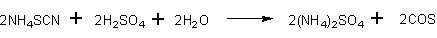Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
углерода оксид-сульфид
Синонимы и иностранные названия:
carbon oxide sulfide (англ.)
carbon oxysulfide (англ.)
carbonyl sulfide (англ.)
карбонилсульфид (рус.)
углерода сероокись (рус.)
углерода сульфоксид (рус.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
оксид-сульфид углерода Тип вещества:
неорганическое
Внешний вид:
бесцветн. газКристаллические модификации, структура молекулы, цвет растворов и паров:
Молекула линейна.
В твердом виде - ромбоэдрические кристаллы.
Брутто-формула (по системе Хилла для органических веществ):
COSФормула в виде текста:
S=C=OМолекулярная масса (в а.е.м.): 60,075
CAS №: 463-58-1
Температура плавления (в °C):
-138,82Температура кипения (в °C):
-50,24Температура разложения (в °C):
300Температура самовоспламенения в воздухе (в °C):
250 [Лит.]
Продукты термического разложения:
углерода(II) оксид; сера ромбическая; Растворимость (в г/100 г растворителя или характеристика):
вода: 0,376 (0°C) [Лит.]
вода: 0,125 (25°C) [Лит.]
кислород жидкий: 0,0053 (-182,8°C) [Лит.]
сероуглерод: хорошо растворим [Лит.]
тетрахлорид титана: 10,5 (0°C) [Лит.]
тетрахлорид титана: 1,11 (100°C) [Лит.]
толуол: 4,62 (22°C) [Лит.]
этанол: 2,71 (22°C) [Лит.]
Плотность:
1,52 (-195°C, г/см3, состояние вещества - кристаллы)
1,24 (-87°C, г/см3, состояние вещества - жидкость)
0,002456 (25°C, г/см3, состояние вещества - газ)
Вкус, запах, гигроскопичность:
запах: без запаха
Энергии, длины и углы связей молекул вещества:
Длина связи (пм): 116 (C=O)
Длина связи (пм): 156 (C=S)
Метод получения 1:
Источник информации: Руководство по препаративной неорганической химии. - Под ред. Брауера Г. - М.: ИИЛ, 1956 стр. 318
В круглодонную колбу, снабженную газоотводной трубкой и находящуюся в водяной бане, вносят охлажденную смесь 2080 г концентрированной серной кислоты и 1000 г воды.
К этой смеси из капельной воронки приливают 200 мл насыщенного раствора NH4CNS. Водяную баню нагревают до температуры около 30°, после чего начинается сильное выделение газа. Время от времени раствор встряхивают. Образовавшийся газ (в котором могут быть примеси аммиака, сероводорода, сероуглерода, двуокиси углерода, цианистого натрия, воды и т. п.) пропускают через 10-шариковую трубку, заполненную 33%-ным раствором едкого натра; затем газ высушивают в двух наполненных известью колонках и колонке, наполненной хлористым кальцием, и, наконец, конденсируют в U-образной трубке, охлажденной до -70°. Выход 75% (считая на HNCS).
От примешанной двуокиси углерода (0,1 об.%) полученный газ отделяют фракционированием в высоком вакууме. Качественно присутствие двуокиси углерода и сероокиси углерода устанавливают oбработкой газа раствором Ва(ОH)2, поскольку COS в первый момент после приведения в контакт с Ва(ОH)2 заметно не реагирует.
Бесцветный, ядовитый газ со слабым запахом.
Т. пл. —138,2°; т. кип.—50,2°. Давление пара при —75° = 210 мм рт. ст. Смеси воздуха с COS при содержании 11,9—26,5 об% COS взрывчаты.
Распадается при 300° на окись углерода и серу. На воздухе горит голубым пламенем с образованием двуокиси углерода и сернистого ангидрида. В сухом состоянии COS устойчива; вода и водяной пар гидролизуют ее. Вода реагирует с COS медленно с образованием двуокиси углерода и сероводорода; раствор KOH быстро поглощает и разлагает COS.
Растворимость COS: при 20 С 0,54 мл в 1 мл воды, при 22 С 8 мл в 1 мл спирта, при 22 С 15 мл в 1 мл толуола. Еще лучше растворяется в сероуглероде. d (ж) при -87 С = 1,24 г/мл, d (г) при 0 С = 1,073 г/л. Теплота образования - 34,1 ккал/моль.
Метод получения 2:
Источник информации: Руководство по препаративной неорганической химии. - Под ред. Брауера Г. - М.: ИИЛ, 1956 стр. 317-318

Воздух из установки (см. рис.) вытесняют, пропуская через нее окись углерода, затем нагревают до кипения чистую серу, находящуюся в сосуде 1, а боковую трубку 2 нагревают в электрической печи до 350°. Образовавшаяся COS проходит вместе с окисью углерода через сосуды 3—7 и конденсируется в ловушке 8; при этом трубку 5 охлаждают до -20°, а трубки 6 и 7 до -60°С. Конденсированный продукт содержит еще около 2% примесей, от которых его очищают фракционированием и высоком вакууме.
Скорость пропуска для газа регулируют таким образом, чтобы поблизости от охлажденной резиновой пробки не оказалось чересчур много пылеобразной серы; в противном случае легко может произойти закупорка трубки. Оптимальная скорость течения газа около 8 л/час; и этом случае выход достигает 75%.
Реакции вещества:
- При нагревании сероокись углерода разлагается до углекислого газа, угарного газа, серы и сероуглерода. [Лит.1]
- Водой сероокись углерода медленно гидролизуется до углекислого газа и сероводорода, поэтому во влажном виде она пахнет сероводородом. [Лит.1]
COS + H2O → CO2 + H2S
- Сероокись углерода легко воспламеняется на воздухе, сгорая до углекислого газа и оксида серы(IV). [Лит.1]
2COS + 3O2 → 2CO2 + 2SO2
Давление паров (в мм рт.ст.):
1 (-133,8°C)
10 (-113,9°C)
100 (-86,1°C)
7600 (20°C)
Дипольный момент молекулы (в дебаях):
0,65 (20°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-141,8 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
231,5 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
41,5 (г)Энтальпия плавления ΔHпл (кДж/моль):
4,73Энтальпия кипения ΔHкип (кДж/моль):
18,51Критическая температура (в °C):
102,25Дополнительная информация::
На воздухе горит голубоватым пламенем. С концентрированными щелочами образует карбонаты и сульфиды.
Источники информации:
- CRC Handbook of Chemistry and Physics. - 95ed. - CRC Press, 2014. - С. 4-56
- Dictionary of organic compounds. - Vol.1, Abadole-Cytosine. - New York, 1953. - С. 429
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 238
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 19
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.3. - Л.: Химия, 1976. - С. 63
- Ефимов А.И. и др. Свойства неорганических соединений. Справочник. - Л.: Химия, 1983. - С. 204-205
- Корольченко А.Я., Корольченко Д.А. Пожаровзрывоопасность веществ и материалов и средства их тушения. - 2 изд, Ч.2. - М.: Ассоциация Пожнаука, 2004. - С. 564
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 513-514
- Пеликс А.А. и др. Химия и технология сероуглерода. - Л.: Химия, 1986. - С. 31-32
- Реми Г. Курс неорганической химии. - Т.1. - М., 1963. - С. 499-500
- Смуров В.С., Аранович Б.С. Производство сероуглерода. - М.-Л.: Химия, 1966. - С. 31-33
- Справочник азотчика. - Т. 1. - М.: Химия, 1967. - С. 289-291
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 368
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 1058
- Справочник химика. - 2 изд., Т.1. - Л.-М.: Химия, 1966. - С. 606, 615 (давление паров)
- Хёрд Ч.Д. Пиролиз соединений углерода. - Л.-М.: ГОНТИ РКТП СССР, 1938. - С. 691
- Химическая энциклопедия. - Т. 5. - М.: Советская энциклопедия, 1999. - С. 27-28
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 603
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер