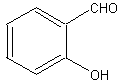

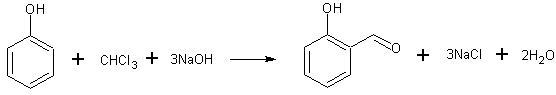
В 2-литровую трехгорлую колбу с мешалкой, обратным холодильником и капельной воронкой помещают 47 г (0,5 моль) фенола, 338,5 г (3 моля) хлороформа, 1,85 г трибутиламина и 500 мл бензола. При температуре 80 С, при перемешивании, добавляют по каплям в течение 1 часа 240 г 50%-ного водного едкого натра. После этого перемешивают еще 30 минут и после этого подкисляют 10%-ной соляной кислотой до pH 1. Фазы разделяют, хлороформенный слой упаривают в вакууме и остаток перегоняют с водяным паром.
Выход 41,3 г (64,5%). Без трибутиламина выход уменьшается до 26%, при замене его на тригексиламин - до 53,4%, на триоктиламин - до 49,0%.
37,6 г фенола (0,4 моля) добавили к 259 г 8%-ного раствора метоксида магния (20,7 г, 0,24 моля) в метаноле и кипятили. После того, как отогналась проимерно половина метанола к остатку добавили 300 г толуола. Азеотропная смесь метанола и толуола отгонялась фракционной дистилляцией пока температура реакционной смеси не повысилась до 95 С.После чего добавляли порциями смесь порошка параформальдегида (43,2 г, 1,44 моля) в 75 г толуола, в течение 1 часа и поддерживая температуру 95 С удалением летучих компонентов смеси дистилляцией. Перемешивание продолжают еще 1 ч при 95 С после чего реакционную смесь охлаждают до 25 С и медленно добавляют 10%-ную серную кислоту (450 г). Полученную смесь перемешивают при 30-40 С 2 часа, после чего отделяют водный слой и экстрагируют толуолом (2 х 100 г). Объединенные органические слои и экстракт промывают 10% серной кислотой (50 г) и водой (50 г) и упаривают под вакуумом получая салициловый альдегид как светло-желтое масло (48,35 г, 84% по данным ГХ, выход 83%).
ПМР (400 MHz; CDCl3; Me4Si) 6.99 (1 H, dd, J 1 and 7.5, 3-H), 7.02 (1 H,dt,J1 and 7.5, 5-H), 7.52 (1H,dt,J1.7 and 7.5, 4-H), 7.55 (1 H, dd, J 1.7 and 7.5, 6-H), 9.9 (1 H, s, CHO) and 11.05 (1H, s, OH); ЯМР-С13 (100.6 MHz; CDCl3; Me4Si) 117.45 (3-C), 119.74 (5-C), 120.53 (1-C), 133.64 (6-C), 136.88 (4-C), 161.45 (2-C) and 196.53 (CHO).
150 г глицерина и 35 г борной кислоты нагревали 30 минут при 170 С (термометр в жидкости) для отгонки всей воды. Затем, при 170 С, добавили 25 г гексаметилентетрамина. Смесь перемешивали и охладили до 160 С, после чего добавили сразу всю порцию (25 г) фенола, температуру снизили до 150-155 С в течение 15 минут перемешивания. Коричневая жидкость была охлаждена до 110 С, в смесь добавили раствор 30 мл концентрированной серной кислоты в 100 мл воды и смесь перегоняли с паром. Перегнанный альдегид требует лишь осушки и перегонки для очистки.
Из 25 г (0,266 моля) фенола было получено 5 г (0,041 моля) салицилового альдегида с т.кип. 197 С (выход 15%), получен его фенилгидразон с т.пл. 142 С.
15 г салициловой кислоты, 18 г п-толуидина (который впоследствии образует с альдегидом основание Шиффа) и карбонат натрия в количестве, достаточном для нейтрализации, растворяют в 1 л горячей воды. Затем к раствору добавляют при комнатной температуре 15 г борной кислоты и 250 г хлористого натрия. К смеси при перемешивании постепенно добавляют 2%-ную амальгаму натрия (330—430 г), поддерживая кислотность раствора добавлением борной кислоты. Реакцию заканчивают, когда при подкислении аликвотной части не выпадает осадка салициловой кислоты. Смесь подкисляют, перегоняют с паром и получают 7,5 г салицилового альдегида.

В колбу с раствором 2 г едкого натра в 2 мл воды при 60—65° добавляют фенол и присоединяют обратную холодильную трубку. Колбу нагревают на водяной бане при 65—70°; когда все растворится, через холодильную трубку добавляют 2 мл хлороформа. Нагревание при указанной температуре продолжают в течение 1 часа, а затем с водяным паром отгоняют избыточный хлороформ. После отгонки окрашенной в оранжевый цвет жидкости дают немного охладиться, затем осторожно подкисляют ее разбавленной серной кислотой. После этого вторично ведут перегонку с водяным паром до прекращения отгонки маслянистых капель. Из погона, собранного в делительную воронку, продукт реакции извлекают эфиром. Эфирный раствор сливают в пробирку и дают испариться большей части растворителя. Остаток сильно встряхивают с двойным объемом концентрированного раствора бисульфита натрия до тех пор, пока бисульфитное производное альдегида не выпадет в твердом виде. Для удаления фенола, переходящего при перегонке, бисульфитное производное после стояния в течение 15 минут трижды промывают спиртом и дважды эфиром. Очищенный таким образом осадок разлагают и выделяют свободный альдегид разбавленной серной кислотой при умеренном нагревании на водяной бане с обратной холодильной трубкой. После охлаждения альдегид извлекают эфиром. Нижний водный слой отсасывают с помощью капиллярного сифона, а эфирный раствор сушат с помощью безводного сернокислого натрия, декантируют в пробирку и после испарения эфира получают чистый салициловый альдегид. Выход: 0,15 г. Полученный препарат кипит при 196 С.
Не перегоняющийся с водяным паром п-оксибензальдегид выделяют из жидкости, оставшейся после отгонки салицилового альдегида. Для этого к ней добавляют поваренную соль и центрифугируют в горячем виде. Из декантированного раствора альдегид выделяется в виде коротких игл часто только после длительного стояния. При обработке маточного раствора эфиром получают дополнительное количество п-оксибензальдегида, которое можно смешать с основным продуктом после кристаллизации из воды, содержащей немного сернистой кислоты. Т. пл. 116°.
Выход: 0,15 г (20% от теоретического). Длительность работы: 4 часа.
В природе салициловый альдегид встречается в маслах некоторых видов спиреи (Spiraea ulmaria, Spiraea digitata).
Летуч с водяным паром.