Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
циклогексен
Синонимы и иностранные названия:
cyclohexene (англ.)
tetrahydrobenzene (англ.)
тетрагидробензол (рус.)
Тип вещества:
органическое
Внешний вид:
жидкостьБрутто-формула (по системе Хилла для органических веществ):
C6H10Молекулярная масса (в а.е.м.): 82,144
Температура плавления (в °C):
-103,5Температура кипения (в °C):
83Растворимость (в г/100 г растворителя или характеристика):
ацетон: смешивается [Лит.]
бензол: смешивается [Лит.]
вода: 0,02799 (4,8°C) [Лит.]
вода: 0,02989 (25,1°C) [Лит.]
диэтиловый эфир: смешивается [Лит.]
лигроин: смешивается [Лит.]
тетрахлорметан: смешивается [Лит.]
этанол: смешивается [Лит.]
Плотность:
0,811 (20°C, г/см3, состояние вещества - жидкость)
Метод получения 1:
Источник информации: Колхаун Х.М., Холтон Д., Томпсон Д., Твигг М. Новые пути органического синтеза. Практическое использование переходных металлов. - М.: Химия, 1989 стр. 67К перемешиваемой суспензии хлорида титана(III) (15,4 г, 0,1 моль) в тетрагидрофуране (200 мл) в атмосфере азота небольшими порциями добавляют алюмогидрид лития (1,9 г, 0,05 моль). Черную суспензию, выделяющую водород, перемешивают 30 мин, затем в течение 30 мин добавляют 1,2-дибромциклогексан (24,2 г, 0,1 моль) и смесь кипятят в течение 8 ч. Добавление водного раствора хлорида аммония, экстракция эфиром и последующая перегонка дают продукт с выходом 78%.
Метод получения 2:
Источник информации: Практикум по органической химии. - Под ред. Зефирова Н.С. - М.: Бином. Лаборатория знаний, 2015 стр. 153-154В круглодонную колбу емкостью 100 мл, снабженную коротким дефлегматором (4-5 "елочек") с термометром, нисходящим холодильником с алонжем и приемником, который охлаждают в бане со льдом, помещают 20 г циклогексанола и 2 мл конц. H2SO4. Реакционную смесь нагревают на плитке или на
песчаной бане до 150–160 °С и собирают медленно отгоняющийся дистиллят в приемник. Через 2 часа нагревание прекращают и прибавляют к дистилляту NaCl до образования насыщенного водного раствора, отделяют циклогексен в делительной воронке и сушат его прокаленным CaCl2.
Получают 11.5 г (70% от теоретического), т. кип. 84 °С / 760 мм рт. ст., nD (20 С) 1.4465.
Чистота циклогексена может быть проконтролирована методом ТСХ (пластинка «Silufol», растворитель CHCl3, свидетель – циклогексанол). В случае необходимости для очистки от следов исходного спирта циклогексен следует прокипятить над натрием (~0,2 г) и затем перегнать над натрием.
ЯМР 1Н (м.д., CDCl3): 1.61 (4Н, ц. м.); 1.99 (4Н, ц. м .); 5.66 (2Н, с).
ЯМР 13С (м.д., CDCl3): 22.7; 25.2; 127.2.
Метод получения 3:
Источник информации: Титце Л., Айхер Т. Препаративная органическая химия. - М., 1999 стр. 53В колбе на 250 мл с насадкой для перегонки 100,2 г (1,00 моль) циклогексанола (т. кип. 161 °С/760 мм. рт. ст.) и 50 г 85%-ной фосфорной кислоты нагревают до 120—160 С, отгоняя образовавшийся циклогексен и воду в приемник.
После этого циклогексен отделяют, сушат над хлоридом кальция и перегоняют. Получают 65,8 г (80%) продукта в виде бесцветной, резко пахнущей жидкости (вытяжной шкаф!), т. кип. 83 °С/760 мм. рт. ст., n (D, 20 C) = 1,4460.
ИК(пленка): 3030 (СН, олеф.), 2940 (СН), 1655 (С=С), 1450, 1430 см-1.
ПМР(CDCl3): 5,60 (м; 2Н, С=СН), 2,2-1,8 (м; 4 Н, СН2-С=С), 1,8-1,4 (м; 4 Н, СН2).
Способы получения:
- Нагревание циклогексанола с 85%-ной фосфорной кислотой при 165-170 С. (выход 79-84%) [Лит.]
- Реакцией 1,2-дибромциклогексана с раствором соли хрома(II) в смеси воды и диметилформамида или воды и этилендиамина. (выход 99%) [Лит.]
Реакции вещества:
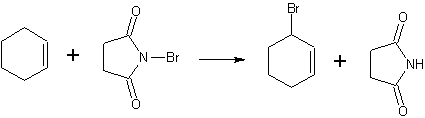
- Реагирует с N-бромсукцинидимом при 80 С в тетрахлорметане в присутствии бензоилпероксида с образованием 3-бромциклогексена. [Лит.]
- Реагирует с иодом и ацетатом таллия(I) в уксусной кислоте при 20 С 4 часа, затем при 90 С 2 часа с образованием транс-1-ацетокси-2-иодциклогексана. (выход 80%) [Лит.]
- Реагирует с тетрафторборатом дипиридиниода(I) и бензолом при 20 С в течение 2 часов с образованием транс-1-иод-2-фенилциклогексана. (выход 41%) [Лит.]
- Реагирует с иодом и тиоцианатом калия в смеси хлороформа и сульфолана (1:1) в темноте в течение 21 часа с образованием транс-1-иод-2-тиоцианатоциклогексана. (выход 96%) [Лит.]
- Присоединяет хлорид иода(I) в присутствии тригидрата ацетата натрия в уксусной кислоте при 20 С в течение 3 часов с образованием транс-1-иод-2-хлорциклогексана. (выход 79%) [Лит.]
- Реагирует с тетрафторборатом дипиридиниода(I) в присутствии бромидов при 20 С в водном диоксане в течение 0,5 часов с образованием транс-1-бром-2-иодциклогексана. (выход 64%) [Лит.]
- Реагирует с тетрафторборатом дипиридиниода(I) в присутствии хлоридов при 20 С в водном диоксане в течение 0,5 часов с образованием транс-1-иод-2-хлорциклогексана. (выход 70%) [Лит.]
- Реагирует с тетрафторборатом дипиридиниода(I) в присутствии тетрафторборной кислоты при -30 С в дихлорметане в течение 3 часов с образованием транс-1-иод-2-фторциклогексана. (выход 67%) [Лит.]
- Присоединяет иод в присутствии оксида меди(II), тетрафторборной кислоты, иодида натрия в дихлорметане при комнатной температуре в течение 4 часов с образованием транс-1,2-дииодциклогексана. (выход 79%) [Лит.]
- При медленном добавлении дииодметана к смеси циклогексена с диэтилцинком образует норкаран. (выход 53%) [Лит.]
- Окисляется перманганатом калия в двухфазной системе при 0 С в присутствии хлорида бензилтриэтиламмония с образованием цис-циклогексан-1,2-диола. (выход 15%) [Лит.]
- Реагирует с дироданом с образованием 1,2-дитиоцианатоциклогексана (выход 73%) [Лит.]
- Реагирует с трет-бутилгипохлоритом в присутствии перекиси бензоила при кипении с образованием 3-хлорциклогексена. (выход 77%) [Лит.]
- Реагирует с бромтрихлорметаном и бутиллитием с образованием дихлорноркарана. (выход 91%) [Лит.]
- Реагирует с N-бромацетамидом и фтороводородом в эфире с образованием транс-1-бром-2-фторциклогексана. [Лит.]
- Реагирует с угарным газом и изопропанолом в присутствии октакарбонила дикобальта с образованием изопропилциклогексилкетона. [Лит.]
- Иодбензол реагирует с циклогексеном в присутствии ацетата палладия(II) при 100 С в течение 15 часов в присутствии триэтиламина с образованием 3-фенилциклогексена. Выход 72%. Название реакции: реакция Хека. [Лит.1]
Показатель преломления (для D-линии натрия):
1,4465 (20°C)
Источники информации:
- CRC Handbook of Chemistry and Physics. - 95ed. - CRC Press, 2014. - С. 3-134
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 283
- Свойства органических соединений: Справочник. - Под ред. Потехина А.А. - Л.: Химия, 1984. - С. 422-423
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер

