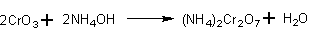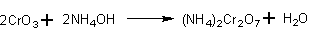Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
аммония дихромат
Синонимы и иностранные названия:
ammonium dichromate (англ.)
аммоний двухромовокислый (рус.)
аммония бихромат (рус.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
дихромат аммонияТип вещества:
неорганическое
Внешний вид:
оранжев. моноклинные кристаллыБрутто-формула (по системе Хилла для органических веществ):
H8Cr2N2O7Формула в виде текста:
(NH4)2Cr2O7Молекулярная масса (в а.е.м.): 252,06
Температура разложения (в °C):
180Продукты термического разложения:
хрома(III) оксид; вода; азот; Растворимость (в г/100 г растворителя или характеристика):
ацетон: не растворим [Лит.]
вода: 18,3 (0°C) [Лит.]
вода: 35,6 (20°C) [Лит.]
вода: 38,7 (25°C) [Лит.]
вода: 46,5 (30°C) [Лит.]
вода: 58,5 (40°C) [Лит.]
вода: 86,6 (60°C) [Лит.]
вода: 115 (80°C) [Лит.]
вода: 155,6 (100°C) [Лит.]
диметилсульфоксид: 45 (25°C) [Лит.]
этанол: растворим [Лит.]
Плотность:
2,15 (25°C, г/см3, состояние вещества - кристаллы)
Метод получения 1:
Источник информации: Карякин Ю.В., Ангелов И.И. Чистые химические вещества. - М., 1974 стр. 37
Растворяют 156 г оксида хрома(VI) CrО3 в 200 мл воды при 45—50 °С, дают отстояться и осторожно сливают раствор с осадка. В стакан или фарфоровую чашку, охлаждаемую льдом, помещают 120 мл прозрачного раствора, охлаждают до 8—10 °С и затем добавляют небольшими порциями при непрерывном помешивании NH4OH (около 60 мл, пл. 0,91) до нейтральной реакции на конго красный, следя за тем, чтобы температура не поднималась выше 15 °С. Раствор охлаждают до 10 °С. Выпавшие кристаллы отсасывают на воронке Бюхнера, промывают 10—15 мл ледяной воды и сушат при 50 °С.
Получают около 50 г препарата, обычно соответствующего квалификации ч. д. а. Маточный раствор после упаривания при 70 °С до образования пленки кристаллов и последующего охлаждения до 10 °С дает еще 30 г менее чистого препарата. Такой продукт можно перекристаллизовать. Для этого 30 г соли растворяют в 45 мл воды при 70—75 °С, фильтруют, фильтрат упаривают при 70 °С до образования кристаллической пленки и охлаждают до 10 °С. Выход —12 г.
Способы получения:
- Реакцией дихромата натрия и хлорида аммония. [Лит.]
Свойства растворов:
27,9% (вес.), растворитель - вода
Плотность (г/см3) = 1,18 (25°)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-1799 (т)Применение:
Окислитель в производстве антрахинона, гидрохинона, бензойной кислоты, искусственной камфоры, красителей, ванилина. Для отбеливания масел, жиров, воска, парафина. Компонент взрывчатых веществ и пиротехнических составов. Для получения соединений хрома (III). Компонент светочувствительного слоя фотоматериалов.
Дополнительная информация::
Термически разлагается с образованием оксида хрома (III), воды и азота с выбрасыванием раскаленных частиц оксида хрома (III); эта реакция часто используется в демонстрационных целях (вулкан).
Источники информации:
- Galwey A.K., Brown M.E. Thermal Decomposition of Ionic Solids. - Elsevier, 1999. - С. 429
- Lewis R.J. Sax's Dangerous Properties of Industrial Materials. - 11ed. - Wiley-interscience, 2004. - С. 230
- Milne G.W.A. Gardner's Commercially Important Chemicals. - Wiley-Interscience, 2005. - С. 33
- Perry D.L. Handbook of Inorganic Compounds. - 2nd ed. - CRC Press, 2011. - С. 21
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 1098
- Иванова М.А., Кононова М.А. Химический демонстрационный эксперимент. - М.: Высшая школа, 1969. - С. 44
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 54
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 221
- Химическая технология неорганических веществ. - Кн.2, под ред. Ахметова Т.Г. - М.: Высшая школа, 2002. - С. 146, 149
- Химическая энциклопедия. - Т. 5. - М.: Советская энциклопедия, 1999. - С. 320
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 42
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер